Über- und Unterdrainage
- die häufigsten "Nebenwirkungen" eines Shuntsystems
Ein Blick zurück auf 70 Jahre Shunt-Historie mit Über- und Unterdrainage
Über- und Unterdrainage sind auf das Engste mit der normalen physikalischen Funktion des Shunts verbunden. Es handelt sich hierbei nicht um eine z.B. durch Unachtsamkeit oder Unverständnis herbeigeführte „Fehlfunktion“, sondern vielmehr um eine zwangsläufige Folge der künstlichen, unphysiologischen Verbindung zwischen normalerweise getrennten Körperhöhlen durch den Shunt. Deshalb ist es so wichtig die physikalischen Grundlagen beider Phänomene zu kennen, um ihnen mit der richtigen Kombination aus Therapie und Technologie entgegen wirken zu können.
mehr lesen„Ein Shunt ist wie ein Pferd, das vor ein Auto mit Motordefekt gespannt wird.“
Der Hydrocephalus hat viele verschiedene Erscheinungsformen und Ursachen. Obwohl das Krankheitsbild schon seit der Antike bekannt ist, sind die meisten dieser Ursachen „nicht besonders gut verstanden“, wie man in der Wissenschaft sagt - oder sogar gänzlich unbekannt. Und Ursachen, die man nicht kennt oder nicht versteht, kann man auch nur schwer bekämpfen. Dabei ist diese Erkrankung gar nicht so selten und kann jede Altersgruppe treffen.
Bis auf den heutigen Tag werden nur die Symptome behandelt, indem der für die Patienten gefährliche Überdruck im Schädel mittels eines Ventils reduziert und in eine andere geeignete Körperhöhle (z.B. häufig den Bauchraum) abgeleitet wird.
SHUNTSYSTEM
Ein Shuntsystem besteht üblicherweise mindestens aus einem Ventrikelkatheter (proximal), einem Ventil (frontal oder occipital) zur Regelung des Öffnungsdruckes und einem (distalen) Katheter für die Ableitung in eine bestimmte Körperhöhle (rechter Herzvorhof oder Bauchraum). Zusätzlich kann so ein Shuntsystem mit einem Reservoir (Bohrlochreservoir oder Vorkammer) ausgestattet sein.
Der erste Shunt wurde vor fast genau 70 Jahren (d.h. 1949) von den beiden Neurochirurgen Spitz und Nulsen in Philadelphia implantiert. Er war so primitiv und fehleranfällig, dass er - soweit bekannt - nur einem einzigen Patienten für kurze Zeit half. Sechs Jahre später wurde das Ventil ganz entscheidend von dem Schlosser John Holter verbessert, so dass man die „Ära der Shunt-Therapie“ meistens erst ab 1955 beginnen lässt. Die berühmte Geschichte, wie John Holter verzweifelt (und leider am Ende doch vergeblich) um das Leben seines neugeborenen, an Hydrocephalus erkrankten Sohnes kämpft, ist auf dieser Webseite besonders eindrücklich beschrieben: HOLTER'S BRAIN DRAIN.
Seitdem ist das Grundprinzip des „Shuntings“ unverändert geblieben: So etwas ist ungewöhnlich im Bereich der Medizin. Rein technisch gesehen hat sich allerdings Vieles deutlich verbessert. Gute Shunts sind heute aus biokompatiblen und widerstandsfähigen Materialien, so dass sie weder brechen, noch korrodieren oder Abstoßungs-Reaktionen hervorrufen. Die Infektionsraten können mit antibakteriellen Kathetern unter 5% gedrückt werden (Ritz1, 2007; Parker2, 2015) und die Öffnungsdrücke sind individuell an die Bedürfnisse des Patienten anpassbar. Viele der Patienten können mit solchen modernen Shunts über lange Zeiträume ein fast unbeeinträchtigtes Leben führen und das ist in der Tat ein großer Fortschritt.
Dennoch führt das immer noch geringe Wissen über die Ursachen eines Hydrocephalus trotz guter, moderner Shunts zu Problemen bei der Behandlung der Erkrankung.
Vielleicht ist es ein hilfreiches Bild, den Shunt mit einem Pferd zu vergleichen, das vor ein Auto mit Motordefekt gespannt wird. Obwohl über die Ursache des Motorschadens nichts Genaues bekannt ist, bewegt sich das Auto wieder (… wenn auch etwas langsamer …) und kann durchaus das ursprünglich geplante Ziel erreichen. Ob eine gerissene Benzinleitung, ein geplatzter Motorblock oder eine defekte Zündkerze ursächlich waren, ist dabei ganz egal, denn die Methode funktioniert erst einmal fast immer. Man muss nur ein paar neue Regeln einhalten: z.B. dem Pferd regelmäßig Futter geben oder Ruhezeiten für das Pferd einhalten. UND: Es können nun plötzlich ganz neue, andere Dinge schief gehen. Das Pferd kann auf holperiger Piste einfach los galoppieren und das Auto in eine falsche Richtung oder sogar in den Graben ziehen. Der Fahrer, der vorher nur sein Auto kennen musste, muss nun auch das Pferd antreiben können und verstehen lernen.
Ein Shunt kann z.B. mit der Zeit verstopfen und bis heute kann man selten mehr dagegen tun, als einen neuen zu implantieren. Ein anderer, besonders unangenehmer, aber unvermeidbarer Nebeneffekt ist das sogenannte „Siphoning“: Aufgrund der physikalischen Gesetze ergibt sich in stehender Position zwischen Kopf und Bauchraum ein hoher Sog (oder negativer Druck) in den Ventrikeln, weil die Flüssigkeit im Katheter durch die Gravitation nach unten gezogen wird. Dieser Sog ist für das Gehirn genau so gefährlich wie der ursprüngliche Überdruck (Hydrocephalus), denn es können z.B. Hirn-Blutungen dadurch hervorgerufen werden. (Ausführliche Informationen zu diesem Phänomen bietet dieser Artikel: "Grundkurs Fluidmechanik oder von Bechern, Flaschen und Menschen?")
Dieser Nebeneffekt kann durch einen normalen Shunt nicht abgefangen werden: es bedarf spezieller Techniken, um ihn zu kompensieren.
Die Unterdrainage, aber mehr noch die besonders gefährliche Überdrainage sind daher auf das Engste mit der normalen physikalischen Funktion des Shunts verbunden. Es handelt sich hierbei nicht um eine z.B. durch Unachtsamkeit oder Unverständnis herbeigeführte „Fehlfunktion“, sondern vielmehr um eine zwangsläufige Folge der künstlichen, unphysiologischen Verbindung zwischen normalerweise getrennten Körperhöhlen durch den Shunt.
Bei der heute nach wie vor häufigen Implantation eines einzelnen verstellbaren Differenzdruckventiles ist entweder eine Überdrainage oder eine Unterdrainage praktisch unvermeidbar und der behandelnde Arzt kann nur durch geschickte Einstellung des Ventils einen unter Umständen „klinisch-akzeptablen“ Kompromiss zwischen beiden herbeiführen. Wirklich zu vermeiden ist insbesondere die Überdrainage und ihre mitunter dramatischen Folgen für den Patienten nur durch die zusätzliche Implantation eines Ventils, das in der Lage ist, diesen physikalischen Kräften entgegen zu wirken, wie im Folgenden gezeigt werden soll.
Unterdrainage bedeutet, dass zu wenig Liquor durch den Shunt abgeführt wird. Der pathologische Überdruck in den Ventrikeln kehrt quasi zurück oder wird nur unzureichend abgebaut. Die ursprünglichen Symptome des Hydrocephalus treten dann teilweise oder vollständig erneut auf: Kopfschmerzen, Schwindel und Übelkeit. Bei Kindern treten ggf. zusätzlich eine Veränderung des Blickes (Sonnenuntergangsphänomen, Stauungspapille) und ein langsames Anwachsen des Kopfumfanges auf. Bei NPH-Patienten sind die Leit-Symptome Inkontinenz, demenzartige Verwirrung und die typische kleinschrittige Gangstörung. Diese äußerlich sichtbaren Symptome sind dabei permanent: vor allem treten sie unabhängig davon auf, ob der Patient steht oder liegt.

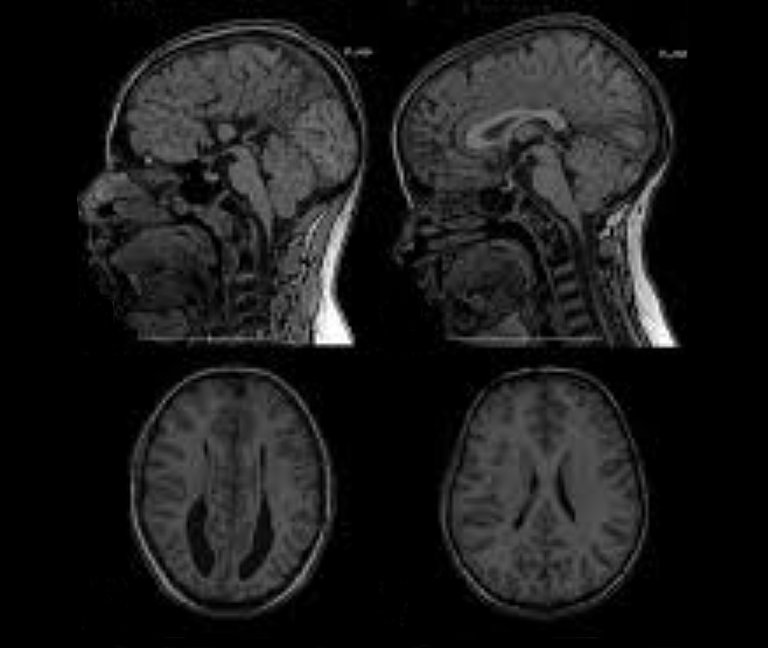
Im MRT- oder CT-Bild zeigt sich unter Umständen, dass der Überdruck bei der Unterdrainage dazu führt, dass sich die Ventrikel weiten und das Hirngewebe komprimiert und von innen gegen die Schädelwand gedrückt wird. Dabei werden Nervenzellen zerstört und sterben ab. Dieser Prozess vollzieht sich in Abhängigkeit von der Höhe des Überdruckes zwar langsam über Wochen und Monate, aber er ist auf Dauer irreversibel, da sich Nervenzellen nicht regenerieren.
Die Unterdrainage ist ohne Weiteres dadurch erklärbar, dass das Ventil einen zu großen Durchflusswiderstand und/oder einen zu hohen Öffnungsdruck hat: es erfüllt einfach nicht ausreichend seine vorgesehene therapeutische Funktion. Ist in so einem Fall ein verstellbares Ventil implantiert, muss daher als erste Gegenmaßnahme der Öffnungsdruck heruntergestellt werden, um das Ventil schon bei einem geringeren Überdruck zu öffnen und somit ein früheres Abfließen von Hirnwasser zu ermöglichen. Führt dies zu keiner Besserung, könnte eine Verstopfung des Ventils vorliegen und eine Revision ist dann unvermeidlich.
Überdrainage bedeutet, dass zu viel Liquor abgeführt wird und ein zu niedriger intraventrikulärer Druck, teilweise sogar ein Sog in den Ventrikeln besteht.
Die äußerlich sichtbaren akuten Symptome sind weitgehend dieselben wie bei der Unterdrainage, nämlich Kopfschmerzen, Schwindel und Übelkeit. Beide Komplikationen sind daher zunächst kaum voneinander zu unterschieden.
In der Bildgebung kann sich bei einer Überdrainage allerdings zeigen, dass die Ventrikel im Unterschied zur Unterdrainage geschrumpft oder sogar ganz in sich zusammengefallen sind – sie werden dann als Schlitzventrikel bezeichnet.
Schlitzventrikel für sich genommen haben zunächst keinen Krankheitswert. Der Begriff bezeichnet nur die Weite der Hirnwasserkammern, die infolge von Überdrainage schlitzförmig verengt sind. Ein solches Erscheinungsbild der Ventrikel im CT oder MRT bestätigt aber z.B. die Verdachtsdiagnose "Überdrainage".
INTRAVENTRIKULÄRER DRUCK
Der intraventrikuläre Druck (engl: Intraventricular Pressure = IVP) ist ein Differenzdruck bezogen auf den äußeren Atmosphärendruck. Ein „negativer IVP“ oder Sog liegt also dann vor, wenn der Druck in den Ventrikeln kleiner als der Luftdruck ist.
Infolge von Überdrainage wird das Hirngewebe unter eine erhebliche Spannung gesetzt, allerdings nicht durch Kompression, sondern durch eine Zug- oder Dehnungsspannung, die die Kortex-Oberfläche von der Schädelwand in Richtung Ventrikel wegzieht. Es gibt sogar dokumentierte Fälle, in denen der ganze Hirnstamm oder das Kleinhirn durch diesen Sog räumlich verschoben werden und das äußerst dünne Aquädukt (der wichtige Verbindungskanal zwischen III. und IV. Ventrikel) dabei abgeknickt wird.
Die bildgebenden Verfahren führen aber nicht immer und auch nicht sofort zu derart eindeutigen Diagnosen, sondern sind häufig unauffällig: die genannte morphologische Veränderung der Ventrikel und des Hirns benötigen einige Zeit und hängen natürlich auch von der Stärke der Überdrainage und der Compliance des Gehirns ab.
Compliance
Ein besonders wichtiger Begriff im Bereich der Hydrocephalus-Therapie ist die sogenannte „Compliance“. Sie charakterisiert nicht nur das Gehirn, sondern das gesamte Zentrale Nervensystem (ZNS), d.h. den Schädelinnenraum und den Rückenmarkskanal. Diese Räume sind überwiegend mit Hirngewebe und Rückenmark gefüllt (ca. 1400 ml) , ebenso mit arteriellem und venösem Blut (zusammen ca. 150 ml, im Verhältnis 1:2) sowie mit CSF (englisch: Cerebrospinal fluid = CSF oder auch „Liquor“ genannt: ca. 150 ml).

Anschaulich gesprochen reflektiert die Compliance etwas wie die „Weichheit“ oder „Elastizität“ des gesamten Schädel- und Spinalraumes. Diese Elastizität ist eine „Pseudo-Elastizität“, denn die Bestandteile Hirngewebe/Rückenmark, Blut und CSF sind für sich genommen inkompressibel, oder anders gesagt, „hart“. Die Compliance kommt so zustande, dass bei jeder zusätzlichen „Raumforderung“ innerhalb des harten Schädelvolumens – z.B. durch einen Aufstau von zu viel CSF (Hydrocephalus), bei einer Blutung (Hämatom) oder durch eine Geschwulst (Krebs, Zyste, Schwellung) – im Wesentlichen venöses Blut aus dem starren Raum nach außen in den Körper verdrängt wird. So steigt der Druck im Schädel (ICP = Intracranial pressure) durch solche Raumforderungen bei normaler Compliance zunächst nur wenig an, weshalb diese auch oft mit einer „Druck-Reserve-Kapazität“ assoziiert wird. Wird die Raumforderung jedoch zu groß, so ist auch die Reservekapazität bald erschöpft und der ICP steigt stark an. Eine Minderung der Compliance ergibt sich aber nicht nur durch eine zu hohe Raumforderung, sondern auch durch pathologische Verhärtung des Gewebes und der Gefäße, vor allem der Venen (Sklerose). Man sagt, die Bestimmung der Compliance hat auch einen „diagnostischen Wert“, denn man erfährt durch sie etwas über die Höhe der Raumforderung und den Zustand des Gewebes bzw. der Blutgefäße.
Die exakte medizinische Definition der Compliance als Druck-Volumen-Beziehung (C = dV/dP) ist in der folgenden Druck-Volumen-Kurve erläutert:

Eine besondere physiologische (natürliche/gesunde) Raumforderung im Schädelinnenraum ergibt sich aus dem periodischen wellenartig Einströmen des arteriellen Blutes. In der folgenden Figur wird illustriert, wie die Amplitude (d.h. die Höhe) der immer vorhandenen ICP-Pulswellen von der Compliance abhängt: hohe ICP-Wellenamplituden zeigen eine verringerte Compliance.

Zwar befinden sich nur wenige Prozent der gesamten CSF-Menge im knöchernen Spinalkanal, dafür aber umso mehr venöses Blut (d.h. Venen). Der „durale Sack“, in dem sich das spinale CSF befindet, ist dehnbar und weitet sich im Stehen durch das Absacken von CSF aus dem Schädel nach unten deutlich auf. Insgesamt trägt der Spinalkanal wahrscheinlich zu mehr als 50% zur gesamten Compliance bei.
Die Überdrainage ist nicht so einfach erklärbar wie die Unterdrainage. Wie kann ein Sog solcher Größenordnung allein durch die Shunt-Implantation entstehen, d.h. durch die künstliche Verbindung der Ventrikel mit dem (vorwiegend) Bauchraum? Der einzige Bereich im menschlichen Körper, in dem ein gewisser moderater Unterdruck (negativer Druck, Sog) herrscht, ist der Pleuraspalt (p = approx. - 5cmH2O), aber der wird als Ableitungsort für die Drainage heutzutage kaum noch in Betracht gezogen. Es gab früher auch Spekulationen über einen „dynamischen Pumpmechanismus“, z.B. bei schreienden Kindern, die sich aber nicht bestätigen ließen.
Eine plausible hinreichende Erklärung findet sich jedoch im sogenannten hydrostatischen Druck (englisch: Hydrostatic Pressure = HSP). Dieser tritt ausschließlich – dann aber zwangsläufig – in stehender Position des Patienten auf und wird durch das Gewicht der sich im Shunt (d.h. vor allem im langen Peritoneal-Katheter) befindlichen Flüssigkeitssäule hervorgerufen. Am unteren Ende des Katheters macht sich dieses Gewicht als Gewichtsdruck der Flüssigkeitssäule bemerkbar, am oberen Ende aber als Sog das ist der hydrostatische Druck (HSP), bzw. je nach Referenzpunkt, hydrostatische Sog. Ohne Ventil läuft die Flüssigkeitssäule einfach aus dem oben und unten offenen Katheter heraus, wobei dieser Vorgang durch das Gewicht der Flüssigkeit getrieben wird. Mit anderen Worten: wenn der Patient aufrecht steht und die obenliegenden Ventrikel über den langen Katheter mit dem untenliegenden Bauchraum verbunden sind, „möchten“ sich diese vollständig entleeren. Man kann das auch so ausdrücken, dass sie „leergesaugt“ werden, weshalb dieser Effekt häufig mit dem Begriff „Siphoning“ bezeichnet wird. Dieser extreme Fall würde allerdings nur dann eintreten, wenn Luft von außen in die Ventrikel nachströmen könnte. Da die Ventrikel aber normalerweise geschlossen sind, fließt nur so viel Liquor ab, bis der hydrostatische Sog durch eine im Hirngewebe entstehende Zugspannung („Gegensog“) ausgeglichen wird: wieviel das im Einzelfall ist, hängt u.a. von der Elastizität des Gewebes (Compliance) und von der Größe des Soges ab.
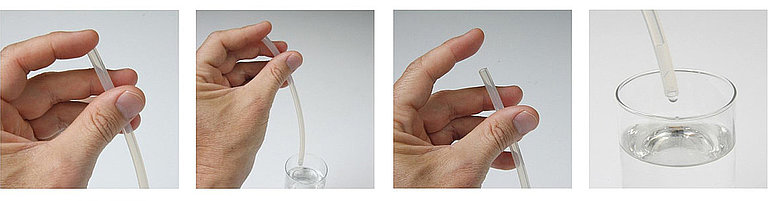
Hydrostatischer Druck in cmH2O
Der Druck im Liquor cerebrospinalis wird im medizinischen Fachjargon in der nicht-SI-Einheit („SI“ steht dabei für Système international d’unités und bezeichnet das internationale Einheitssystem für physikalische Größen) cmH2O ausgedrückt - gesprochen: „Zentimeter-Wassersäule“. Es ist ein sogenannter Differenzdruck, der den Druckunterschied (d.h. die Druckdifferenz) zwischen Schädelinnerem und äußerem Luftdruck beschreibt.
Ein cmH2O ist definiert als der hydrostatische Druck, den eine Wassersäule von einem Zentimeter Höhe bei einer Dichte von exakt einem Gramm pro Kubikzentimeter Wasser bewirkt. Anders als bei der für Druck üblichen Einheit Pa - gesprochen: „Pascal“ - die definiert ist als die Kraft eines Newtons, die auf eine Fläche von einem Quadratmeter wirkt, handelt es sich bei der Einheit cmH2O um eine Größe, die ganz ohne Wirkfläche auskommt. Sie bezieht sich lediglich auf ein eindimensionales Längenmaß, nämlich die Höhe der Wassersäule, die auf dem betrachteten Druckpunkt lastet. Dies entspricht nicht unserem intuitiven Verständnis von Druck, verdeutlicht dafür jedoch umso mehr die Wirkung des hydrostatischen Drucks – also dem Druck in einem Medium (z.B. in einer Flüssigkeit), der durch das Eigengewicht dieses Mediums selbst hervorgerufen wird. In anderen Worten: der Druck entsteht, weil das Medium mit seinem eigenen Gewicht auf sich selber drückt.
Ein cmH2O entspricht in etwa einem Millibar oder in SI-Einheiten ausgedrückt: tausend Pascal.
Der Hydrostatische Druck wird nach der Formel:
HSP = rho * g * h
berechnet. Dabei ist h die Höhe der Flüssigkeitssäule und rho und g physikalische Konstanten.
Bei einem durchschnittlichen Erwachsenen kann somit ohne Weiteres einen Sog von - 50 cmH2O erreicht werden. Dass die Verjüngung der Ventrikel die genannte starke Zugspannung erzeugt, liegt daran, dass das Gehirn an seiner Außenseite fest mit dem Schädel verbunden ist und daher nicht insgesamt „schrumpfen“ kann.
Dieser physikalischen Formel gemäß verschwindet dieser Effekt in liegender Position, denn die Höhe der Säule beträgt hier ja h = 0 cm, also auch HSP = 0. Das ist auch anschaulich ganz plausibel, denn die Flüssigkeitssäule im „liegenden“ (horizontalen) Katheter wird jetzt nicht mehr durch ihr Eigengewicht seitlich aus den Katheter-Enden herausgepresst. Mit anderen Worten: mit dem Bauchraum verbundene Ventrikel werden im Liegen auch nicht mehr leergesaugt. Der „Siphon-Effekt“ ist in dieser Lage nicht mehr vorhanden.
Es sei an dieser Stelle nochmal betont, dass dieser physikalische Effekt IMMER und UNVERMEIDLICH im Stehen auftritt, und – je nach Größe des Patienten bzw. je nach Abstand der Ventrikel vom Zwerchfell – einen massiven Sog von 20 - 60 cmH2O erzeugt. Dieser ist dann ohne Weiteres in der Lage, die oben beschriebenen Symptome wie Schlitzventrikel und sogar die räumliche Verschiebung von ganzen Hirnteilen hervorzurufen. Aus dieser rein physikalischen Erklärung wird auch klar, dass im Unterschied zur Unterdrainage, die an sich ganz ähnlichen Überdrainagesymptome NUR im Stehen auftreten, im Liegen aber relativ rasch wieder abklingen. Dies bietet ein gutes diagnostisches Unterscheidungskriterium zwischen beiden Phänomenen.
Das kritische Problem bei der Überdrainage ist also nicht primär der niedrige, intraventrikuläre Druck, sondern die Tatsache, dass durch die Dehnung des Hirngewebes die Bildung von Hygromen und Hämatomen, d.h. flüssigkeits- und blutgefüllten Hohlräumen vor allem zwischen Hirn-Oberfläche und Schädel gefördert wird. Das Gehirn ist über die fein-strukturierte sogenannte „Spinngewebshaut“ (Arachnoidea) und die Dura-Mater fest mit dem Schädel verbunden und kann sich normalerweise nicht von diesem lösen. Entsteht nun ein zu großer Sog nach innen, also von der Schädelwand weg, ist es zuerst diese feine Haut und die in ihr verlaufenden dünnen Brückenvenen, die reißen und einbluten. Es können aber auch große venöse Sinusgefäße in der Dura oder Arterien verletzt werden. Durch die Überdrainage werden fast ausschließlich sogenannte "Subdurale Hämatome" (SDH) hervorgerufen und diese können sogar chronisch werden. Laborexperimente belegen eindrucksvoll wie ein typischer hydrostatischer Sog in den Ventrikeln von ca. - 30 cmH2O an den fixierten äußeren Hirnhäuten Kräfte von mehreren hundert Gramm (Gewichtsäquivalent) hervorrufen kann. In dem beschriebenen Szenario ist es klar, dass Überdrainage-Hämatome sogar chronisch werden können (cSDH = chronical subdural haematoma).
Ein anderes durch die Überdrainage induziertes und ebenso gravierendes Problem ist das sogenannte Schlitzventrikelsyndrom (SVS). Durch das sog-induzierte Zusammenziehen der Ventrikel können die feinen Öffnungen des Ventrikelkatheters (VK) verschlossen werden. Der Liquor kann dann nicht mehr abgeführt werden und die Ventrikel weiten sich wieder. Wird der Sog danach erneut wirksam, beginnt der Prozess von vorne. Diese periodische, mit starken Spannungen verbundene Kontraktion und Expansion der Ventrikel kann das Gewebe bereits schädigen. Wächst dann noch Gewebe in die kleinen Katheterlöcher ein, kann dies bei der nachfolgenden Ventrikelexpansion zu weiteren Geweberissen und Blutungen führen. Wenn der Ventrikelkatheter dabei irreversibel verstopft wird, bleiben die Ventrikel eng und eine Shunt-Revision wird unvermeidlich. Rolf Gruber hat diese Phase des SVS bereits 1987 folgendermaßen beschrieben:
„Bei der Shuntrevision lässt sich der fixierte Ventrikelkatheter nur mühsam entfernen, sein Lumen ist durch inkarzerierte Gewebspfröpfe in den Ostien komplett oder partiell verlegt. Sie bestehen aus vaskularisierter Neuroglia, Plexusanteilen und Blutkoageln. Ependymzellen werden nur an den abgerissenen Gewebsfragmenten außerhalb, jedoch nie innerhalb des Katheters gefunden.“ [Gruber3, Das Schlitz-Ventrikel-Syndrom, 1987].
Viele Autor*innen gehen bis heute davon aus, dass diese nachweislichen Verletzungen des Ependyms durch chronische Überdrainge (d.h. nicht nur bei Kindern) zu einer dauerhaften Versteifung/Verhärtung der Ventrikelwände und einer damit einhergehenden erniedrigten Hirncompliance führen („stiff ventricles“). Für diese Hypothese spricht, dass die Ventrikel nach einer Wiederherstellung physiologischer, d.h. „normaler“ Druckverhältnisse nicht unbedingt zu ihrer ursprünglichen Ventrikelweite zurückkehren [Pollay4 1994, Ros5 2018, Wagner6 2018]. Untersuchungen des Beitrages pathologischer Zellveränderungen zu dieser mutmaßlichen Ventrikelversteifung haben jedoch bisher keine endgültige Klarheit schaffen können [Oi91986, Del Bigio7 2002, Di Rocco8 2015, ].
Das Ventil ist sehr häufig retroauriculär, d.h. auf der Höhe der Ventrikel implantiert. Die Bezeichnung „Sog“ macht hier besonders deutlich, dass der negative HSP „unterhalb“ des Ventils durch die hängende Flüssigkeitssäule hervorgerufen wird und nichts mit dem pathologischen Überdruck in den Ventrikeln zu tun hat. Der hohe Sog im Stehen lässt sich immer durch einen besonders hohen Öffnungsdruck (OPmax) des Ventils kompensieren und daher ist das Hochstellen des Ventils durch den behandelnden Arzt auch die erste Gegenmaßnahme, wenn eine Überdrainage vermutet wird. Bei erhöhtem intraventrikulärem Druck (IVP) öffnet das Ventil und reduziert diesen so lange, bis die Summe aus IVP und HSP den Öffnungsdruck des Ventils wieder unterschreitet. Der IVP wird durch die Flüssigkeitsabfuhr reduziert, aber der Sog im Katheter (Höhe h!) bleibt dabei immer konstant. Die Ventrikel werden auf diese Weise sozusagen vom Sog abgeschirmt und sind geschützt.
Im Liegen ist jedoch kein Sog mehr vorhanden (HSP = 0 cmH2O), aber das hochgestellte Ventil öffnet weiterhin nur dann, wenn die Summe aus IVP und Sog den Öffnungsdruck übersteigt. In Formeln ausgedrückt bedeutet das:
IVP + HSP = IVP + HSP LIEGEN = IVP + 0 > OP MAX
Diese Konstellation führt notwendig zu einem unter Umständen massiven Überdruck, d.h. zu einer deutlichen Unterdrainage. Um gegenzusteuern, müsste - wie eingangs bereits erwähnt - der Öffnungsdruck wieder auf einen niedrigen Wert OPmin gesenkt werden, aber dann wird der Sog im Stehen nicht mehr kompensiert: in dieser Konstellation wäre das Ventil permanent geöffnet und eine Überdrainage die unvermeidliche Folge. Die Schlussfolgerung ist also, dass mit einem einfachen Ventil - je nach Typ oder Einstellung - zwangläufig eine Über- oder eine Unterdrainage auftritt (Bergsneider10, 2004).
Physiologischer und pathologischer Hirndruck – Wann ist es zu viel? Wann zu wenig?
Der intraventrikuläre Druck (IVP) ist auch beim gesunden Menschen keine Konstante: durch Luftanhalten oder Pressen steigt er deutlich an. Puls- und atmungsinduzierte Druckwellen sind neben einigen anderen immer vorhanden. Neben personenspezifischen, tages- und situationsspezifischen Schwankungen ist er im Liegen generell leicht positiv und im Stehen leicht negativ. Dieser physiologische (d.h. normale) Unterdruck im Stehen wird durch das Absacken des Hirnwassers in den Spinalkanal hervorgerufen und gleicht insofern dem oben beschriebenen, durch den Peritonealkatheter hervorgerufenen hydrostatischen Sog. Der durch den Spinalkanal erzeugte physiologische Sog wird allerdings durch verschiedene natürliche Mechanismen deutlich reduziert. Einerseits ist dieser Kanal nicht wie der Katheter nach unten hin geöffnet und der Liquor kann deshalb gar nicht ablaufen, sondern nur im Stehen nach unten hin „absacken“. Der Spinalkanal hat nämlich genau wie die Ventrikel und das Gehirnparenchym eine gewisse Elastizität (Compliance).
Ein weiterer Mechanismus, der ein zu starkes Abfallen des intraventrikulären Druckes im Stehen verhindert, ist der „Kollaps der Jugularvenen“, die vom Hirn zum Herzen nahe unter der Halsoberfläche entlang führen. Außer im Halsbereich sind die Venen nämlich im ganzen Körper und im Gehirn („Sinus sagittalis“) mit dem umgebenden Gewebe verspannt, so dass sie nicht zusammenfallen können. Der Halsbereich ist die einzige Stelle, wo sie sich schon bei leichtem negativen Druck im Stehen zusammenziehen („kollabieren“). Ergo: auch das venöse Blut stellt eine hydrostatische Säule dar. Ist der venöse Blutfluss erst unterbrochen, steigt der venöse Hirndruck und mit ihm der intraventrikuläre Druck wieder an.
Das Gehirn ist jedenfalls auf deutliche Druckschwankungen ausgelegt und kann diese sehr gut tolerieren. Wahrscheinlich ist sogar - wie bei fast jedem biologischen Zellgewebe - eine bestimmte „Bewegung“ wünschenswert und physiologisch sinnvoll. Konkret fürs Hirngewebe könnte die durch die Druckschwankungen hervorgerufene Kompressions- und Zugspannung im Parenchym für den Transport von Nährstoffen und das Abführen von Stoffwechselprodukten hilfreich oder sogar notwendig sein.
Ein gewisser Unterdruck in den Ventrikeln muss also nicht per se „schädlich“ sein. Entscheidend ist am Ende weder irgendein ICP-Lehrbuch-Wert (den es gesichert und allgemein akzeptiert bisher gar nicht gibt (Pedersen11, 2018)) noch die absolute Weite der Ventrikel im MRT-Bild. Entscheidend ist allein die Frage, ob der Patient beschwerde- und symptomfrei ist und sich wohl fühlt. Es hat sich über lange Zeiträume gezeigt, dass der „optimale” Hirndruck von Patient zu Patient sehr variabel ist (Antes12, 2018). Beispielsweise hat sich für die spezielle Gruppe der sogenannten „NPH-Patienten“ (englisch: Normal Pressure Hydrocephalus = NPH) seit der großen Studie von Boon und Mitarbeitern im Jahre 1998 (Boon13, 1998; Malem14 2014) die Etablierung eines besonders niedrigen (vermutlich unphysiologischen?) Hirndruckes als zuträglich für ein „positives klinisches Outcome“ erwiesen.
In den letzten Jahren scheinen lumbo-peritoneale Shunts (LP-Shunts) immer beliebter zu werden, da hier Schädel und Gehirn nicht verletzt werden müssen. Beim LP-Shunt wird der Liquor vom Spinalkanal, der direkt mit den Ventrikeln verbunden ist, zwischen dem dritten und fünften Lendenwirbelkörper (LWK) ins Peritoneum abgeleitet. Bis heute wird in der Literatur manchmal die Ansicht vertreten, beim LP-Shunt spiele der hydrostatische Sog keine bedeutende Rolle und die Gefahr einer Überdrainage sei hier deutlich kleiner (Bloch15, 2012). Diese vollkommen falsche und irreführende Aussage entsteht wahrscheinlich durch den Umstand, dass beim LP-Shunt Liquorquelle (Spinalkanal) und Drainageort (Peritoneum) nicht übereinander, sondern „scheinbar auf gleicher Höhe“ liegen: der Shunt-Katheter zwischen Punktionsort und Bauchraum liegt ja tatsächlich im Mittel horizontal, so dass die hydrostatische Höhe h = 0 zu sein scheint.

Wie bereits weiter oben erklärt wurde, erhebt sich aber im Stehen der gesamte liquorgefüllte Spinalkanal bis hin zu den Ventrikeln über dem Bauchraum. Durch den Shunt ist der Kanal nun allerdings geöffnet, die spinale Flüssigkeitssäule kann in den Bauchraum abfließen und in den Ventrikeln entsteht dabei exakt der gleiche hydrostatische Sog (der Höhe h) wie im Falle eines ventriculo-peritonealen Shunts. Da der Spinalkanal wesentlich breiter als der dünne Peritonealkatheter ist und der Liquorfluss somit größer, tritt die Überdrainage sogar deutlich schneller ein. In einer aktuellen Übersichtsarbeit (Miyake16, 2016) wird die ähnliche, missverständliche Bemerkung gemacht, „der Siphon-Effekt sei für LP-Shunts zu vernachlässigen“. Dies ist differenziert zu betrachten: „aus Sicht des LP-Ventiles“, das ja auf der Höhe des Bauchraumes liegt, ist tatsächlich kaum Sog vom Bauchraum (d.h. „von unten“) her vorhanden. Dafür lastet allerdings zusätzlich zum IVP der gesamte hydrostatische Druck des Spinalkanales „von oben“ auf ihm. Beim VP-Shunt ist es umgekehrt: das Ventil liegt auf Höhe der Ventrikel und „von unten“ zieht der gesamte hydrostatische Sog, wohingegen „von oben“ nur der vergleichsweise geringe IVP einwirkt. Für die Öffnung eines herkömmlichen Differenzdruckventiles ist jedoch ausschließlich die Summe aus beiden Druck/Sog-Anteilen relevant. Zur Überdrainage kommt es daher in beiden Fällen gleichermaßen.
Außer vorliegenden Indizien und Plausibilitätsüberlegungen ist es in den letzten Jahrzehnten noch nicht gelungen, die Über- oder Unterlegenheit eines bestimmten Ventiltyps zweifelsfrei nachzuweisen. Die normalerweise geradezu dahinrasende naturwissenschaftliche Erkenntnis scheint hier langsam wie eine Schnecke zu kriechen. Neben vielen anderen gewichtigen Gründen hat dies sicherlich auch damit zu tun, dass die menschliche Physiologie äußert kompliziert ist und sich belastbare statistische Aussagen meist nur mit massivem Aufwand gewinnen lassen. Deshalb soll insbesondere der differenzierten Abwägung der Vor- und Nachteile der verschiedenen marktgängigen hydrostatischen Implantate in einem späteren Kapitel genügend Raum eingeräumt werden.
Dennoch kann und soll für die Gravitationsventile an dieser Stelle bereits gesagt werden, dass ihre effektive Wirksamkeit bei der Vermeidung von Überdrainage in der wissenschaftlichen Literatur sehr gut belegt ist, und dies für jede Altersgruppe. Die folgende Liste an jüngeren Studien ist dabei nur als Auswahl zu verstehen: Al-Hakim17, 2018; Gebert18, 2016; Xinxing19, 2015; Suchorska20, 2015; Kehler21, 2015; Malem14, 2014; Thomale22, 2013; Lemcke23, 2013; Gebert24, 2013; Freimann25, 2013.
Ein Ergebnis der unter Neurochirurgen gut bekannten SVASONA Studie (Lemcke23, 2013) ist, dass eine Überdrainage bei jedem dritten Patienten mit Gravitationsventilen vermieden werden kann. Zwar ist in dieser Studie die Überdrainagerate „in der Kontrollgruppe“ (d.h. in der Gruppe, in der keine Gravitations-Ventile implantiert wurden) deutlich höher als in anderen Studien (Sundstrom26, 2017), aber nichts desto Trotz die entsprechende Rate in der Therapiegruppe (mit Gravitations-Ventilen) auch auffällig klein. Dass dies für viele Therapiegruppen mit Gravitations-Ventilen gilt, hat gerade Alfred Aschoff, ein bei Neurochirurgen bekannter Hydrocephalus-Experte, in seinem jüngst erschienen Lehrbuch-Kapitel über Shunt-Ventile (Aschoff27, 2019) angemerkt.
In diesem reichhaltigen Text hat Aschoff auch die sogenannten „Überlebenskurven“ (oder auch Kaplan-Meier-Kurven) für verschiedene Ventile „übereinander gelegt“, um sie direkt zu vergleichen. „Überlebenskurven“ sind in der Shunttherapie weit verbreitet, denn sie zeigen graphisch, wie viele (in Prozent) der anfänglich implantierten Ventile nach einer bestimmten Zeit noch „überlebt“ haben, d.h. weiterhin fehlerfrei arbeiten. Die übrigen wurden revidiert, d.h. wegen einer Fehlfunktion oder Komplikation operativ entfernt. Eine wichtige, unter Umständen irreversible Komplikation ist eben auch die hier diskutierte Überdrainage, die somit zu einer verkürzten Lebens/Funktionszeit des Ventiles beiträgt. Andere wichtige Gründe für ein Shuntversagen sind Infektionen, Verstopfungen und mechanische Fehlfunktionen, wie Bruch des Ventils oder Abreißen des Katheters. In den von Aschoff miteinander verglichenen Überlebenskurven stammen die oberen Kurven alle aus Studien mit Gravitations-Ventilen: im Unterschied zu den herkömmlichen Vergleichsventilen, bei denen nach 2 Jahren nur noch ca. 50-60% fehlerfrei arbeiten, sind bei den Gravitations-Ventilen nach derselben Zeit noch ca. 80% vorhanden.
Die von Aschoff gefolgerte „Überlegenheit der Gravitations-Ventile“ hat sich ebenfalls in den offiziellen Leitlinien für die „Diagnostik und Therapie des Normaldruckhydrozephalus“ niedergeschlagen, die von der Deutschen Gesellschaft für Neurologie periodisch herausgegeben werden:
www.awmf.org/uploads/tx_szleitlinien/030-063_S1_Normaldruckhydrozephalus_2018-03.pdf
Dort heißt es unter der Rubrik „Wichtige Empfehlungen“:
„Wenn zur Behandlung des iNPH ein ventrikuloperitonealer Shunt gelegt wird, sollte ein gravitationsabhängiges Ventil implantiert werden. Differenzialdruckventile mit verstellbarem und insbesondere mit nichtverstellbarem Ventilöffnungsdruck führen bei gleichem klinischem Effekt signifikant häufiger zu Überdrainage-Komplikationen“.
Literaturverzeichnis
- Ritz R, Roser F, Morgalla M, Dietz K, Tatagiba M, Will BE. Do antibiotic-impregnated shunts in hydrocephalus therapy reduce the risk of infection? An observational study in 258 patients. BMC Infect Dis. 2007 May 8;7:38. doi: 10.1186/1471-2334-7-38.
- Parker SL, McGirt MJ, Murphy JA, Megerian JT, Stout M, Engelhart L. Comparative effectiveness of antibiotic-impregnated shunt catheters in the treatment of adult and pediatric hydrocephalus: analysis of 12,589 consecutive cases from 287 US hospital systems. J Neurosurg. 2015 Feb;122(2):443-8. doi: 10.3171/2014.10.JNS13395. Epub 2014 Nov 21.
- Gruber R. Das Schlitzventrikel-Syndrom: die hydrostasebedingte Shuntkomplikationen des kindlichen Hydrozephalus. In: Bibliothek für Kinderchirurgie. Stuttgart: Hippokrates Verlag; 1987. Kapitel 9.
- Pollay M. Slit ventricle syndrome. Crit Rev Neurosurg. 1994;4:51-56.
- Ros B, Iglesias S, Martín Á, Carrasco A, Ibáñez G, Arráez MA. Shunt overdrainage syndrome: review of the literature. Neurosurg Rev. 2018 Oct;41(4):969-981. doi: 10.1007/s10143-017-0849-5. Epub 2017 Mar 29.
- Wagner W. Therapie des Hydrozephalus. In: Pädiatrische Neurochirurgie. 1. Aufl. Springer Verlag; 2018. p. 261-271.
- Del Bigio MR. Neuropathological findings in a child with slit ventricle syndrome. Pediatr Neurosurg. 2002 Sep;37(3):148-151. doi: 10.1159/000064396
- Di Rocco C, Turgut M, Jallo G, Martinez-Lage JF. Cranio-cerebral disproportion as a late complication. In: Di Rocco C, Turgut M, Jallo G, Martinez-Lage JF, editors. Complications of CSF Shunting in Hydrocephalus: Prevention, Identification and Management. Berlin: Springer; 2015. p. 233-246.
- Oi S, Matsumoto S. Morphological findings of postshunt slit-ventricle in experimental canine hydrocephalus. Aspects of causative factors of isolated ventricles and slit-ventricle syndrome. Childs Nerv Syst. 1986;2(4):179-84. doi: 10.1007/BF00706807.
- Bergsneider M, Yang I, Hu X, McArthur DL, Cook SW, Boscardin WJ. Relationship between valve opening pressure, body position, and intracranial pressure in normal pressure hydrocephalus: paradigm for selection of programmable valve pressure setting. Neurosurgery. 2004 Oct;55(4):851-8; discussion 858-9. doi: 10.1227/01.neu.0000137631.42164.b8.
- Pedersen SH, Lilja-Cyron A, Andresen M, Juhler M. The Relationship Between Intracranial Pressure and Age-Chasing Age-Related Reference Values. World Neurosurg. 2018 Feb;110:e119-e123. doi: 10.1016/j.wneu.2017.10.086. Epub 2017 Oct 26.
- Antes S, Stadie A, Müller S, Linsler S, Breuskin D, Oertel J. Intracranial Pressure-Guided Shunt Valve Adjustments with the Miethke Sensor Reservoir. World Neurosurg. 2018 Jan;109:e642-e650. doi: 10.1016/j.wneu.2017.10.044. Epub 2017 Oct 17.
- Boon AJ, Tans JT, Delwel EJ, Egeler-Peerdeman SM, Hanlo PW, Wurzer HA, Avezaat CJ, de Jong DA, Gooskens RH, Hermans J. Dutch Normal-Pressure Hydrocephalus Study: randomized comparison of low- and medium-pressure shunts. J Neurosurg. 1998 Mar;88(3):490-5. doi: 10.3171/jns.1998.88.3.0490.
- Malem DN, Shand Smith JD, Toma AK, Sethi H, Kitchen ND, Watkins LD. An investigation into the clinical impacts of lowering shunt opening pressure in idiopathic normal pressure hydrocephalus: A case series. Br J Neurosurg. 2015 Feb;29(1):18-22. doi: 10.3109/02688697.2014.950630. Epub 2014 Aug 21.
- Bloch O, McDermott MW. Lumboperitoneal shunts for the treatment of normal pressure hydrocephalus. J Clin Neurosci. 2012 Aug;19(8):1107-1111. doi: 10.1016/j.jocn.2011.11.019.
- Miyake H. Shunt Devices for the Treatment of Adult Hydrocephalus: Recent Progress and Characteristics. Neurol Med Chir (Tokyo). 2016 May 15;56(5):274-83. doi: 10.2176/nmc.ra.2015-0282. Epub 2016 Apr 4.
- Al-Hakim S, Schaumann A, Schneider J, Schulz M, Thomale UW. Experience in shunt management on revision-free survival in infants with myelomeningocele. Childs Nerv Syst. 2018 Jul;34(7):1375-1382. doi: 10.1007/s00381-003-0759-4.
- Gebert AF, Schulz M, Schwarz K, Thomale UW. Long-term survival rates of gravity-assisted, adjustable differential pressure valves in infants with hydrocephalus. J Neurosurg Pediatr. 2016 May;17(5):544-551.
- Xinxing L, Hongyu D, Yunhui L. Using individualized opening pressure to determine the optimal setting of an adjustable proGAV shunt in treatment of hydrocephalus in infants. Childs Nerv Syst. 2015 Aug;31(8):1267-1271.
- Suchorska B, Kunz M, Schniepp R, Jahn K, Goetz C, Tonn JC, Peraud A. Optimized surgical treatment for normal pressure hydrocephalus: comparison between gravitational and differential pressure valves. Acta Neurochir (Wien). 2015 Apr;157(4):703-9. doi: 10.1007/s00701-015-2345-4. Epub 2015 Feb 11.
- Kehler U, Kiefer M, Eymann R, Wagner W, Tschan CA, Langer N, Rohde V, Ludwig HC, Gliemroth J, Meier U, Lemcke J, Thomale UW, Fritsch M, Krauss JK, Mirzayan MJ, Schuhmann M, Huthmann A. PROSAIKA: a prospective multicenter registry with the first programmable gravitational device for hydrocephalus shunting. Clin Neurol Neurosurg. 2015 Oct;137:132-136.
- Thomale UW, Gebert AF, Haberl H, Schulz M. Shunt survival rates by using the adjustable differential pressure valve combined with a gravitational unit (proGAV) in pediatric neurosurgery. Childs Nerv Syst. 2013 Mar;29(3):425-31. doi: 10.1007/s00381-012-1956-9. Epub 2012 Nov 8.
- Lemcke J, Meier U, Müller C, Fritsch MJ, Kehler U, Langer N, Kiefer M, Eymann R, Schuhmann MU, Speil A, Weber F, Remenez V, Rohde V, Ludwig HC, Stengel D. Safety and efficacy of gravitational shunt valves in patients with idiopathic normal pressure hydrocephalus: a pragmatic, randomised, open label, multicentre trial (SVASONA). J Neurol Neurosurg Psychiatry. 2013 Aug;84(8):850-7. doi: 10.1136/jnnp-2012-303936. Epub 2013 Mar 1.
- Gebert AF, Schulz M, Haberl H, Thomale UW. Adjustments in gravitational valves for the treatment of childhood hydrocephalus: a retrospective survey. Childs Nerv Syst. 2013 Nov;29(11):2019-2025. doi: 10.1007/s00381-021-05250-4.
- Freimann FB, Vajkoczy P, Sprung C. Patients benefit from low-pressure settings enabled by gravitational valves in normal pressure hydrocephalus. Clin Neurol Neurosurg. 2013 Oct;115(10):1982-6. doi: 10.1016/j.clineuro.2013.06.010. Epub 2013 Jul 4.
- Sundström N, Lagebrant M, Eklund A, Koskinen LD, Malm J. Subdural hematomas in 1846 patients with shunted idiopathic normal pressure hydrocephalus: treatment and long-term survival. J Neurosurg. 2018 Sep;129(3):797-804. doi: 10.3171/2017.5.JNS17481. Epub 2017 Oct 27.
- Aschoff A. In-depth view: functional characteristics of CSF shunt devices (pros and cons). In: Di Rocco C, editor. Textbook of Pediatric Neurosurgery. Cham: Springer; 2019.