Der Innovationssprung zu telemetrischen Drucksensoren
Die Messung des intrakraniellen Drucks
Vorwort
mehr lesenDer Innovationssprung zu telemetrischen Drucksensoren
Weil solche Sensoren zur Messung physisch an externe Ausleseeinheiten angeschlossen werden müssen, sind sie nur in der Klinik und unter kontrollierten Bedingungen einsetzbar; sie schränken die Mobilität von Patient*innen ein und stellen ein Infektionsrisiko dar.5-7 Da das Infektionsrisiko jedoch mit der Messdauer korreliert, sind solche konventionellen ICP-Sensoren für Messungen über Tage oder Wochen hinaus ungeeignet.4
Bei verschiedenen Erkrankungen ist es jedoch erforderlich, den intrakraniellen Druck über mehrere Jahre hinweg wiederholt zu überwachen, um ein zufriedenstellendes Therapieergebnis zu gewährleisten.8 Beispielsweise hat sich die ICP-gesteuerte Ventilverstellung zur Therapie potenziell gefährlicher und unspezifischer Kopfschmerzen als nützliches Instrument für das Hydrocephalus-Management erwiesen.9 Vor allem aber bietet die Langzeitüberwachung des ICP eine quantitative Methode zur Diagnose und Therapieunterstützung, die einen klaren Vorteil gegenüber der vagen Interpretation von Symptomen (z. B. Kopfschmerzen, Übelkeit) hat.5 Bei Patient*innen, die sich einer solchen wiederholten konventionellen ICP-Überwachung unterziehen, sind aktuell mehrere chirurgische Eingriffe erforderlich.
Neben den skizzierten Risiken weisen die konventionellen ICP-Sensoren noch eine Reihe weiterer Nachteile aus. Viele dieser Sensoren müssen vor Implantation initial durch das medizinische Personal in einer aufwändigen Prozedur vorbereitet und kalibriert werden, um eine ausreichende Genauigkeit zum Implantationszeitraum zu erreichen.10 Derzeitige ICP-Monitore weisen darüber hinaus eine signifikante Basisliniendrift u.a. durch Alterung der Sensorik auf.7 Zusammen mit spontanen starken Basislinienverschiebungen (> 10-20 mmHg) durch die Empfindlichkeit gegenüber elektrostatischen Entladungen und Temperaturänderungen werden mit zunehmender Messdauer höhere Ungenauigkeiten beobachtet.11-13 Fehlende Möglichkeiten zur Überprüfung der Druckwerte können dazu führen, dass Behandlungsentscheidungen aufgrund falscher ICP-Werte getroffen werden.11 Ein Austausch des konventionellen ICP-Sensors kann wegen der beobachteten Drift schon fünf Tage nach Implantation erforderlich sein.14 Bei bis zu 13 % der Patient*innen wurde darüber hinaus von einer versehentlichen Dislokation durch Patient*innenbewegung, einem Bruch oder einer Fehlfunktion berichtet, wodurch ebenfalls ein Austausch des konventionellen ICP-Sensors erforderlich wurde.15 Einige der herkömmlichen ICP-Sensoren enthalten ferromagnetische Komponenten, so dass die betroffenen Patient*innen nicht mittels MRT untersucht werden können.16
Das sind einige Ergänzungen zur ausführlichen Diskussion der technischen Anforderungen an ICP-Sensoren und der Grenzen konventioneller Systeme. Gesammelt ergeben sich daraus umfassende Markt- und Patient*innen-Anforderungen an Sensoren zur Messung intrakranieller Drücke: ICP-Sensoren sollten genau, zuverlässig, und langzeitstabil sein; mit geringer Drift, hoher Abtastrate > 25 Hz sowie einer hohen Datenübertragungsqualität arbeiten; möglichst klein und einfach zu bedienen sein und nur wenige Infektionen und hämorrhagische Komplikationen während einer hohen Lebensdauer verursachen.
Vor diesem Hintergrund stellen telemetrische Sensoren zur Messung intrakranieller Drücke einen zukunftsweisenden Ansatz dar.
Die Prüfung der Shunt-Funktion zeigt eine hohe Relevanz: Der Verdacht auf Fehlfunktion oder Verstopfung gehört nach wie vor zu den häufigsten Gründen für eine Shunt-Revision.19-21
Tatsächlich können bei einem/einer von vier Patient*innen Shunt-assoziierte Komplikationen auftreten, weshalb eine effiziente Shuntfunktionskontrolle von hoher Wichtigkeit ist.19 Shunt-Revisionen erhöhen massiv die Belastung für Patient*innen und Pflegepersonal und reduzieren die ohnehin begrenzte Zeit der Neurochirurgen noch weiter. Nach dem operativen Entfernen des Shunts erweist sich dieser Verdacht jedoch nicht immer als zutreffend, denn eine suboptimale oder beeinträchtigte Shunt-Funktion lässt sich mit herkömmlichen Methoden wie CT, MRT oder Pumpen oft nicht mit Sicherheit diagnostizieren.22-27
CT ist zudem mit einer unerwünschten erhöhten Strahlenbelastung verbunden.28Welcher Anteil der Revisionen retrospektiv tatsächlich durch eine akute Shunt- oder Katheter-Funktionsstörung gerechtfertigt war, lässt sich ebenfalls nur schwer valide bestimmen. Eine hierfür geeignete Studie müsste nach der eingehenden Untersuchung des Shunts die Revision u. U. als unnötig bzw. überflüssig klassifizieren. Die Analyse unserer über ein Jahrzehnt umfassend geführte Reklamationsdatenbank zeigt tatsächlich, dass die beanstandeten Probleme (wie z. B. Verstopfung) für den überwiegenden Teil der reklamierten Shunt-Komponenten nicht nachgewiesen werden können. Dies gilt zumindest für die voluminöseren Shunt-Komponenten, wie die verschiedenen Ventile und Reservoire. Verstopfte oder gerissene Katheter werden bedauerlicherweise selten zurückgesendet, so dass valide quantitative Aussagen bislang schwer möglich sind. Für Patient*innen wie für behandelnde Ärzt*innen ist es jedoch von allerhöchster Priorität, unnötige Operationen zu vermeiden. Daneben sind die Reduktion unnötiger Kosten und der sparsame Einsatz von Ressourcen in der Gesundheitsversorgung schon immer zentrale Elemente gewesen. Aus diesen Gründen kann eine nicht-invasive, nicht belastende und dennoch sichere Shunt-Funktionskontrolle, wie sie das M.scio bietet, von außerordentlicher Bedeutung sein.
Das Implantatdesign des M.scios orientiert sich an der Bauform typischer Komponenten der allermeisten Shunts, wie z. B. der Bohrloch- oder Inline-Reservoire. Dadurch macht das M.scio bei der üblichen Standard-Shunt-Implantation keine zusätzlichen Operationsschritte erforderlich. Der enthaltene Drucksensor ist derart miniaturisiert und in das Implantat integriert, dass er die Flusseigenschaften des Shunts in keiner Weise beeinträchtigt. Da die Messelektronik ihre notwendige Energie für Messungen aus dem elektromagnetischen Feld der Antenne des zugehörigen Reader Unit Sets bezieht, benötigt das M.scio auch keine eigene Batterie, die wie bei anderen aktiven Implantaten ausgewechselt werden müsste. Hierdurch und durch die vollständige hermetische Verkapselung der Messelektronik in eine robusten Titanhülle wird eine theoretisch unbegrenzte Implantationsdauer des M.scio ermöglicht.
Anmerkung
Aus regulatorischen Gründen ist die Angabe einer Mindest-Lebensdauer erforderlich. Für das M.scio wurden fünf Jahre spezifiziert. Es gibt jedoch keinerlei technische Gründe oder klinische Hinweise, die die einwandfreie Funktion des M.scio über diese formal definierte Lebensdauer hinaus einschränken würden.
Die inzwischen über mindestens vier Jahre nachgewiesene annähernde Driftfreiheit der Messwerte von Abweichungen < 2 mmHG in 4 Jahren ermöglicht noch nach einer langen Zeit eine sichere Funktionalität.
Auch bei einem unwahrscheinlichen Totalausfall seiner Druckmessfunktion muss das M.scio nicht revidiert werden, sondern übernimmt weiterhin die Funktion eines einfachen Reservoirs, einer Vorkammer, eines Deflektors oder eines Konnektors.

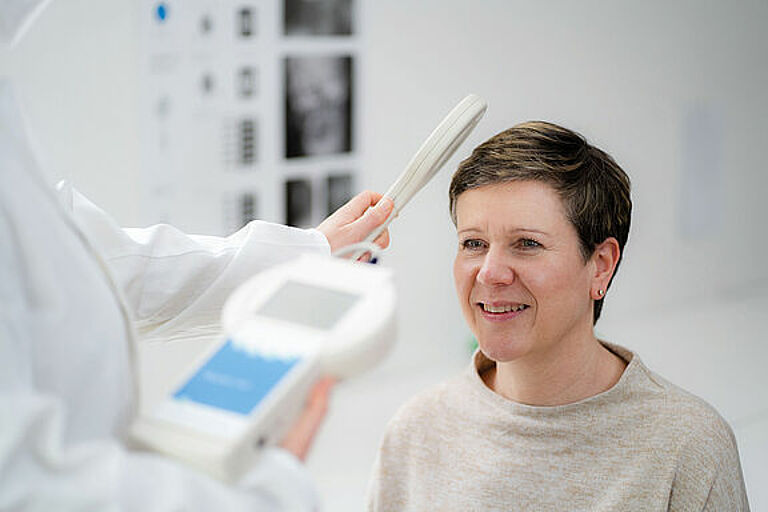
Mit der Antenne des zugehörigen externen Reader Unit Sets, die über das implantierte M.scio gehalten wird, kann der Druck innerhalb des Shunts (d.h. normalerweise zwischen der Spitze des Ventrikel-Katheters und dem ersten Differenzdruckventil) bestimmt werden. Der so gemessene Shunt-interne Druck (SID) ist nicht ohne weiteres identisch mit dem intraventrikulären Druck (IVD). Letzterer wird aber durch ein kurzes Stück flüssigkeitsgefülltem Silikonkatheter direkt aus den Ventrikeln zum M.scio übertragen und ist deshalb auf das Engste mit diesem verknüpft. Außer einer minimalen Dämpfung/Verzögerung von schnellen, dynamischen IVD-Verläufen bewirkt diese Anordnung, dass im Stehen der vom M.scio gemessene Druck um einige cmH2O niedriger als der wahre IVD ist, weil sich zwischen M.scio und Ventrikel eine hydrostatische Flüssigkeitssäule ausbildet. Im Liegen dagegen befinden sich der Ventrikel (bzw. der Referenzpunkt Foramina Monroi) und das M.scio auf vergleichbarer Höhe und der Messdruck entspricht dann in guter Näherung dem IVD. Der Vollständigkeit halber sei erwähnt, dass sich bei geöffnetem Ventil CSF (CSF - Liquor cerebrospinalis, umgangssprachlich Hirnflüssigkeit) durch den Shunt an der Messzelle vorbei bewegt und in diesem Fall noch eine minimale dynamische Druckkorrektur nach Bernoulli berücksichtigt werden müsste. Diese theoretisch mögliche und einfache Herleitung des IVDs aus dem Messwert des M.scios spielt allerdings für die Shunt-Funktionskontrolle (SFK) keine wesentliche Rolle.
Die folgenden Beispiele 1) - 7) dienen deshalb ausschließlich der Veranschaulichung theoretisch möglicher Prozeduren und es kann keine Verantwortung für deren praktische Durchführung übernommen werden. Die Verantwortung liegt ausschließlich beim/bei der behandelnden Arzt/Ärztin.
1. Bei absichtlich herbeigeführter Hyperventilation des/der Patient*in sollte ein rascher Druckabfall in den Ventrikeln und auch im Shunt messbar sein. Andernfalls sind eine Okklusion oder Trennung der proximalen Verbindung zwischen M.scio und Ventrikel wahrscheinlich.
2. Eine analoge Überlegung gilt für die Durchführung des Valsalva-Manövers, bei dem von Patient*innen gegen die verschlossene Nasen- und Mundöffnung angeatmet/angepresst wird. Sind M.scio und Ventrikel ordnungsgemäß verbunden, dürfte hier ein rascher Druckanstieg messbar sein.
3. Ein solcher unmittelbarer Druckanstieg sollte sich ebenso durch ein Absenken des Kopfes bzw. der Ventrikel aus der liegenden Position unter das Niveau der Spinalsäule, z. B. durch eine entsprechende Kippung des Bettes (in Richtung „Kopfstand“), ergeben. Auch dies reflektiert die störungsfreie Funktion des Ventrikelkatheters.
4. Im Zweifelsfalle könnte sich der Arzt / die Ärztin entscheiden, das Ventil bzw. die Ventile kurzzeitig im Stehen herunter zu stellen, um den gewünschten Effekt einer „künstlichen Überdrainage“ zu erzeugen. Ist dieser Effekt sichtbar, so kann von einer distalen Durchgängigkeit des Shunts ausgegangen werden. Der Grund hierfür liegt darin, dass der Überdrainage-Sog sich nur ausbilden kann, wenn die Flüssigkeitssäule im distalen Katheterteil grundsätzlich frei beweglich ist und nicht von einer Okklusion gehemmt wird.
Generell ist davon auszugehen, dass sich eine Verstellung des Ventil-Öffnungsdruckes nicht in so einfacher, linearer Weise in der Druck-Messung zeigen wird, wie es das simplifizierte hydrostatische Becher-Modell suggeriert.30,31
5. Dennoch sollte sich jede relevante Verstellung eines funktionstüchtigen Shunts (d. h. eine Verstellung um mindestens einige cm-Wassersäule) kurzfristig auch in Änderungen der Messwerte widerspiegeln, ansonsten besteht die Wahrscheinlichkeit einer Shunt-Funktionsstörung. Wie genau sich die Verstellung eines einwandfrei funktionierenden Shunts auf den tatsächlichen IVD auswirkt, ist Gegenstand jüngerer Forschung.32,33
Die genannten notwendigen Voraussetzungen für die SFK sind beim M.scio mühelos erfüllt, denn mit bis zu 44 Einzelmessungen pro Sekunde erzielt es eine bisher für telemetrische in-situ Drucksensoren unerreichte Abtastrate. Gerade dieses besondere Alleinstellungsmerkmal wurde in der jüngsten Literatur unglücklicherweise fälschlich und irreführend als eine maximale zeitliche Auflösung von 1 Hz statt 44 Hz beschrieben.34 Hiermit (d. h. mit 44 Hz) kann das M.scio nicht nur die durch den Herzschlag induzierte P-Welle (Puls) sichtbar machen, sondern sogar deren „Feinstruktur“ darstellen.
Abbildung 1 zeigt eine typische Schnellmessung mit dem M.scio, bei der die vergleichsweise hochfrequente P-Welle kardialem Ursprungs (engl. pulse wave, lila) und die langsamere atmungsinduzierte R-Welle (engl. respiratory wave, grün) deutlich erkennbar sind. Abbildung 2 zeigt, dass die P-Welle selbst noch eine Feinstruktur aus (mindestens) drei verschiedenen Maxima besitzt, die bei einer Schnellmessung mit dem M.scio durchaus sichtbar wird. Die P-Welle wird durch die pulsatile Druckschwankung der arteriellen Blutversorgung des Gehirns erzeugt, die sich auf verschiedenen Wegen, wie vor allem über den Plexus Choroideus, den Subarachnoidalraum und das arterielle Kapillarbett, auf die Cerebrospinalflüssigkeit überträgt.

Abbildung 1: Exemplarisches Beispiel einer M.scio Schnellmessung mit 44 Hz Abtastrate, auf der deutlich eine Überlagerung der Puls-induzierten P-Wellen (lila) und der langsameren Atmungs-induzierten R-Wellen (grün) zu sehen sind.

Abbildung 2: Vergrößerter Ausschnitt des Druckverlaufs aufgenommen mit dem M.scio. Mit einer maximalen zeitlichen Auflösung von 44 Hz kann mit Hilfe von M.scio-Messdaten einerseits die P-Wellen-Amplitude bestimmt und ebenso deren Feinstruktur (in Form der Peaks P1, P2 und P3) sichtbar gemacht werden.
6. Deshalb sollte die P-Welle in jeder Schnellmessung mit dem M.scio sichtbar sein, ansonsten müsste von einer verstopften oder getrennten proximalen Verbindung zu den Ventrikeln ausgegangen werden.
Zwar variiert die Amplitude der P-Welle deutlich, u.a. in Abhängigkeit von der intrakraniellen Compliance, und transportiert somit eine wichtige diagnostische Information, aber ein gänzliches Verschwinden (d. h. Amplitude = 0) ist in der Regel nicht möglich.35-37 Daher ist mit einer solchen Schnellmessung mit dem M.scio eine besonders einfache und robuste Funktionskontrolle des proximalen Teils des Shunts möglich, die sogar ganz ohne ärztliche Manipulation oder Mithilfe der Patient*innen auskommt. Das heißt: Sichtbare P-Wellen deuten auf eine Durchgängigkeit des Shunts zwischen Ventrikel und M.scio hin.
7. Theoretisch ist es möglich, dass durch die Implantationsprozedur das intrakranielle CSF-Volumen durch den CSF-Verlust reduziert und die intrakranielle Compliance dadurch temporär (d. h. kurz nach der OP) erhöht ist. Hierdurch wären die Pulsationen im Drucksignal des M.scio nicht oder nur schwer zu erkennen. Abhilfe könnte hier das oben diskutierte Beispiel 2) liefern, da durch ein Vasalva-Manöver i. d. R. größere Druckänderungen als bei P-Wellen hervorrufen werden und somit eine Morphologieänderung zu erkennen wäre.
Aus diesen Betrachtungen und Überlegungen wird ersichtlich, dass
- einerseits die Shuntsfunktionskontrolle ein wichtiges, aber noch nicht standardisiertes Gebiet ist, das es zu beobachten und weiterzuentwickeln gilt.
- andererseits das M.scio Potential für verschiedene Anwendungen hat. Denkbar und in ersten Studien beschrieben sind z.B.
- Messung des intrakraniellen Drucks17
- Druckmessungen im Stand-Alone-Modus, d.h. nicht als Teile eines Shunts17
- Shunt-Einstellungen basierend auf Druckmessungen 9, 18
- Gewinnen von Parametern wie der Amplitude der P-Wellen und deren Feinstruktur, aus denen sich therapeutisch-diagnostische Informationen u. a. über die intrakranielle Compliance ergeben könnten39
Um die reale, vollumfängliche Nutzung des M. scio im Bereich der Shuntfunktionskontrolle in der klinischen Paraxis zu reflektieren, haben wir eine Benutzerumfrage durchgeführt, die im Folgenden beschrieben wird.
Die für eine Befragung kontaktierten Neurochirurgen wurden im Wesentlichen nach der (möglichst hohen) Anzahl der implantierten M.scio ausgewählt. Hierdurch sollte die größtmögliche Anzahl von implantierten Produkten zusammen mit der umfänglichsten Anwendererfahrung erfasst werden. Im Falle ihrer Zustimmung zur Teilnahme wurde diesen sogenannten „Power-Usern“ ein 4-seitiger Fragebogen mit folgenden 12 Fragen (Kurzfassung siehe unten) vorgelegt.
Anmerkung
Zur Zeit der Durchführung der Befragung lautete die Produktbezeichnung des M.scio noch SENSOR RESERVOIR bzw. SENSOR VORKAMMER. Seit Anfang 2020 lautet deren Name nun M.scio, dome-angled bzw. dome-inline und es werden inzwischen zusätzlich die beiden Varianten M.scio, flat-angled bzw. flat-inline angeboten.)
Der Fragebogen wurde uns anschließend ausgefüllt und unterschrieben zur Auswertung zurück übermittelt.
1. Wie viele welcher Produktvarianten – SENSOR RESERVOIR oder SENSOR VORKAMMER – haben Sie bis heute implantiert?
2. Bei welchen Patientengruppen haben Sie das SENSOR RESERVOIR / die SENSOR VORKAMMER hauptsächlich implantiert?
3. Aus welchen Gründen haben Sie die Produkte SENSOR RESERVOIR / SENSOR VORKAMMER implantiert?
4. Bevorzugen Sie eine der beiden Produktvarianten (RESERVOIR oder VORKAMMER) und aus welchen Gründen?
5. Konnten Sie eine Shuntfunktionskontrolle (SFK) mittels Messung mit dem SENSOR RESERVOIR oder der SENSOR VORKAMMER durchführen?
6. Bezogen auf Frage 5: Waren die Messungen auch für andere Zwecke hilfreich?
7. Wie viele Implantate laufen seit ihrer Implantation komplikationsfrei?
Frage 8 - 10: Nur zu beantworten, wenn eine Fehlfunktion oder Komplikation in Verbindung mit dem SENSOR RESERVOIR / SENSOR VORKAMMER aufgetreten ist.
8. Bei wie vielen SENSOR RESERVOIREN / SENSOR VORKAMMERN traten Fehlfunktionen bzw. Komplikationen auf? Welche Komplikationen oder Fehlfunktionen?
9. Nach welchem Zeitraum traten die Komplikationen im Durchschnitt auf?
10. War eine der genannten Komplikationen oder Fehlfunktionen ursächlich für eine Revision des SENSOR RESERVOIRS / der SENSOR VORKAMMER oder des gesamten Shuntsystems?
11. Haben Sie Anregungen oder Wünsche zur Verbesserung des SENSOR RESERVOIRS / der SENSOR VORKAMMER ?
12. Ihre grundlegende Bewertung oder ein Abschlusskommentar zum SENSOR RESERVOIR / der SENSOR VORKAMMER ?
Wir erhielten alle 19 versandten Fragebögen ausgefüllt zurück und zwar aus 18 verschiedenen Kliniken in Großbritannien, Deutschland, Italien, Spanien und Tschechien. Die so erhaltenen Daten stammen von Implantationen in ausnahmslos allen Patientengruppen, von Frühgeborenen, Kindern, über Erwachsene bis hin zu älteren NPH-Patienten.
Alle Fragebögen waren konsistent, so dass keine Daten von der Auswertung ausgeschlossen werden mussten. Die insgesamt erfasste Stichprobe hatte einen Umfang von 284 Implantaten, was einem hohen Anteil der Grundgesamtheit entspricht. Durch die erfolgte Befragung der „Power-User“ erhält man generell mehr Daten, und dies von erfahrenen Anwendern, die die Vor- und Nachteile, die Leistung und die u. U. vorhandenen Gefährdungen durch die Nutzung des M.scio besser einschätzen können, als solche, die nur über vereinzelte Erfahrung verfügen. Deshalb gehen wir mit großer Sicherheit davon aus, dass diese Daten ein valides und belastbares Gesamtbild des M.scio und seiner klinischen Anwendung zeichnen (siehe folgende Abbildung 3).
Abbildung 3 zeigt die wichtigsten Resultate der Umfrage auf einen Blick:

Abbildung 3: Übersicht über die wichtigsten Ergebnisse unserer M.scio-Anwenderbefragung.
Die Umfrage umfasst 284 Implantate. Auf die Frage nach der allgemeinen Bewertung (Frage 12) bewerteten 100 % aller befragten Anwender das M.scio als hilfreich, genauer: 44 % als eher hilfreich und 56 % als sehr hilfreich (Mitte). Außerdem konnten 95 % der befragten Anwender die „Shunt-Funktionskontrolle“ in der überwiegenden Zahl der Fälle erfolgreich durchführen - Frage 5. Die Ergebnisse zur Lebensdauer (Frage 7) werden in Abbildung 3 (rechts) reflektiert: 26 % der 284 Implantate waren z. Zt. der Umfrage kürzer als ein Jahr implantiert, 19 % zwischen ein und zwei Jahren, 13 % zwischen zwei und drei Jahren, 38 % sogar länger als drei Jahre. 4 % der Implantate wurden wegen Shunt-Problemen, die nicht ersichtlich durch das M.scio verursacht worden waren (also z. B. Infektion, Okklusion) revidiert. Alle diese M.scio, d. h. 99 % der gesamten Stichprobe, funktionierten implantiert oder auch nach der Revision fehlerfrei und zeigten keinerlei Ausfallserscheinungen.
Mit diesem Befund korrespondieren auch die Antworten auf die Fragen 8-10, die alle elektronischen, mechanischen und sonstigen Fehlfunktionen erfassen. Außer drei temporären/reversiblen Fehlermeldungen (z. B. Temperatur-Error-Message auf dem Display des Reader Unit Sets) wurden keine weiteren Probleme gemeldet, insbesondere keine, die für Revisionen ursächlich waren.
1 % der M.scios, d. h. drei Stück, wurden wegen Infektionen revidiert. Diese waren durch Implantat-induzierte Wundheilungsstörungen ausgelöst worden, wobei zwei davon denselben Patienten betrafen. Tatsächlich hat das bei der Befragung untersuchte klassische M.scio (Varianten „dome-angled“ und „dome-inline“) mit 7,75 mm eine vergleichsweise hohe Bauform und es ist bereits in der Literatur reflektiert worden, dass dies für empfindliche Patient*innen oder Kleinkinder problematisch sein kann.9 Antes et al. beschreiben dort eine Rate für diese Wundheilungsstörung von 2/25 = 8 %.9 Eine derartige Komplikationsrate von 1-8 % mag angesichts des hohen Nutzens kein unvertretbar hohes Risiko darstellen, jedoch haben 79 % der befragten Ärzt*innen ihrem Wunsch nach einer niedrigeren Implantat-Höhe im Rahmen der Fragen 11 & 12 deutlich Ausdruck verliehen [siehe auch 38]. Wir haben auf diese Anforderung reagiert und zwei Varianten mit einer um 40 % reduzierten Bauhöhe von nun 4,8 mm entwickelt, die unter den Variantenbezeichnungen flat-angled und flat-inline seit Anfang 2020 zugelassen und erhältlich sind.
In der gesamten Zeit seit der Zulassung waren nur drei Totalausfälle der Messzelle bekannt geworden, d. h. ein vollständiger irreversibler Verlust der elektronischen Messfunktion. Wie bereits erwähnt, muss das M.scio deswegen aber nicht revidiert werden, sondern verbleibt z. B. als normales Reservoir oder als Konnektor in Patient*innen.

Bei den im Rahmen der Fragen 11 & 12 geäußerten Anwender*innen-Wünsche zeichnete sich eine weitere wichtige Anforderung ab, die durch folgende Stichworte aus der Umfrage umrissen wird: „long duration measurement“, „continous monitoring“, „home monitoring/measurement“, „head fixation or helmet“, „smaller antenna“, „smaller reader“. Dieser Forderungs-Komplex wurde immerhin von 47 % der Anwender*innen gewünscht bzw. genannt. Das erscheint zunächst unverständlich, denn das M.scio bietet bereits einen Langzeitmessmodus an, mit dem (nur begrenzt durch die Kapazität der Speicherkarte) theoretisch Messungen über Monate möglich sind. Nach unseren Analysen verbirgt sich dahinter der (teilweise auch explizit ausgedrückte) Wunsch nach einer handlicheren Antenne und einem kleineren Lesegerät, so dass eine permanente Kopffixierung erleichtert wird. Damit sollen Langzeitdruckmessungen nicht nur stationär, sondern auch in alltäglicher Umgebung (z. B. im „Home Monitoring“) möglich werden. Diese Forderung wird ebenso in der Literatur reflektiert.39 Der von Norager et al. dort getroffenen Aussage, dass eine Fixierung der Antenne am Kopf prinzipiell unmöglich sei, stimmen wir so kategorisch zwar nicht zu, denn diese wurde nachweislich in der klinischen Praxis durchgeführt. Unbestreitbar ist eine solche permanente Fixierung jedoch bisher schwierig und unkomfortabel.
In dieser Forderung von fast 50 % der Anwender*innen zeigt sich deutlich deren Erwartung und teilweise auch deren Praxis, dass das M.scio eben nicht nur für relative und kurzfristige Druckmessungen im Rahmen der SFK eingesetzt wird, sondern auch als „Hirndrucksonde“ für Langzeit-Messungen von Absolutwerten.
Die Fragen 3 und 6 adressieren genau diesen Themenkomplex der erweiterten Anwendung. Sie fragen nach den ursprünglichen Gründen für die Implantation des M.scio und nach dessen tatsächlicher Nützlichkeit bei zusätzlichen Anwendungen außer der Shuntfunktionskontrolle. Dabei zeigt sich in aller Deutlichkeit, dass 100 % der Anwender*innen das M.scio auch für zusätzliche Anwendungen einsetzen. Die hierzu genannten signifikanten Stichworte aus der Umfrage sind: „complex/demanding patient/hydrocephalus“, „valve/shunt adjustment“, „ICP measurement“, aber auch „therapy support“ und „research“. Außer den letzten beiden Stichworten haben alle anderen gemeinsam, dass es unseren Analysen zufolge letztlich immer um Hirndruckmessung geht. Zu der umgangssprachlich häufig „complex/demanding patients“ genannten Patient*innengruppe gehören zunächst diejenigen, deren Symptome diffus oder unspezifisch sind und die nicht durch eine einfache Ventilverstellung gelindert werden können. Wie z. B. Antes et al. oder Pennacchetti et al. jüngst beschrieben haben, kann sich in solchen schwierigen Fällen eine Abschätzung des IVDs aus M.scio-Messungen als hilfreich erweisen, um daraus die Richtung und das Ausmaß der erforderlichen Ventilverstellung zu ermitteln.9,17 Wie oben bereits erwähnt, ist das naive lineare hydrostatische Bechermodell für eine solche Abschätzung wenig zielführend.30,31 Auch von Norager et al. wird eine Nutzung des M.scio für die IVD-Messung als Leitlinie für die Ventilverstellung beschrieben.39 In dieser Fallbeschreibung wurde auch gleich eine Kontrollkalibration durch Punktion des Reservoirs durchgeführt, wobei erfolgreich die erforderliche absolute Genauigkeit und Driftfreiheit des M.scio nachgewiesen werden konnte. Zu der Gruppe der „complex/demanding patients“ gehören ebenso die IIH-Patient*innen, deren besondere Behandlung z. B. von Thompson beschrieben wurde.43 Neben der Möglichkeit der Druckmessungs-gestützten Ventilverstellung weist Thompson in dieser Publikation darauf hin, dass “die telemetrische Hirndruckmessung bei IIH Patienten das Potential hat, in den nächsten Jahren zur Routine zu werden“, u.a. auch wegen des „positiven subjektiven Feedbacks von Patienten und ihren Familien“.40 Hier geht es darum, dass diese Patient*innengruppe dafür bekannt ist, Symptome zu entwickeln, die nicht unmittelbar mit einer Hirndruckkrise zu tun haben. Die einfache Feststellung des Arztes, dass der Hirndruck im normalen Bereich oder wenigstens seit der letzten Untersuchung unverändert ist, hat hier oft einen signifikanten positiven therapeutischen Effekt.
In einer jüngst publizierten retrospektiven Studie an 81 Patient*innen zeigen Galloway et al., dass durch die Implementierung eines Standardprotokolls beim Shunten von IIH-Patient*innen die Revisionsrate innerhalb der ersten 30 Tage nach der OP signifikant von 22 % auf 6 % gesenkt werden konnte.41 Das Protokoll empfiehlt u.a. die Implantation eines verstellbaren Gravitationsventils, als auch die des M.scios für die ICP-Überwachung. Dies lässt sich als erste positive Bestätigung des von Thompson prognostizierten großen Potentials der telemetrischen Hirndruckmessung bei IIH-Patienten werten.
Der durch die Anwender berichtete Einsatz des M.scio im sogenannten "Stand-Alone-Modus" hat ebenfalls das Ziel, den intrakraniellen Druck zu bestimmen. Dabei ist das M.scio nicht Teil eines (CSF-durchflossenen) Shunts, stattdessen wird es eigenständig implantiert. Das proximale Ende wird dabei wie üblich mit den Ventrikeln (oder beispielsweise einer Hirnzyste) verbunden, das distale Ende ist jedoch blind verschlossen. Der zu messende Druck wird genau wie bei der Shunt-integrierten Anwendung durch den flüssigkeitsgefüllten Ventrikelkatheter zum M.scio übertragen. Bei der Berechnung des IVDs muss daher auch hier die Lage und Größe der hydrostatischen Zusatzsäule im Ventrikelkatheter berücksichtigt werden, eine dynamische Korrektur (nach Bernoulli) ist jedoch nicht notwendig. Eine solche Art der Anwendung ist in unserer Umfrage immerhin drei Mal, also von 16 % der Anwender*innen, beschrieben worden, und auch aus anderen Quellen ist uns diese Nutzung bekannt.17,39,42,43 Wenn es erforderlich wird, z. B. bei Feststellung/Messung eines pathologischen Überdrucks, kann diese Konstellation leicht zu einem Shunt erweitert werden, indem zusätzlich ein Ventil mit distalem Peritonealkatheter implantiert wird.
Zulassungserweiterung
Basierend auf den sehr positiven Ergebnissen der PMCF-Umfrage und der in der Literatur beschriebenen breiten Anwendung des M.scio war es möglich, die Zweckbestimmung des Produkts auf diagnostische, intrakranielle Druckmessung innerhalb des Liquor cerebrospinalis zu erweitern.
Es wurde in der dargestellten Anwender*innenbefragung 2019 festgestellt, dass 95 % aller befragten Anwender*innen die Shunt-Funktionskontrolle in der Mehrheit der Fälle mit dem M.scio realisieren konnten, wobei 56 % das Implantat sehr nützlich, 44 % eher nützlich fanden. Außer der vergleichsweisen hohen Bauhöhe der Varianten dome, die bei empfindlichen und jungen Patient*innen zu Wundheilungsstörungen führen kann, ließen sich keine weiteren Risiken nachweisen. Um dieses Risiko zu adressieren, wurden Anfang 2020 zwei um 40 % flachere Varianten zugelassen. Für 38 % der Implantate ist eine störungsfreie Funktion seit über drei Jahren belegt. 13 % waren zur Zeit der Umfrage störungsfrei zwischen zwei und drei Jahren implantiert, 19 % zwischen ein und zwei Jahren, und 26 % weniger als ein Jahr. Es gibt keine Anzeichen dafür, dass hier in der Zukunft Ausfälle zu erwarten sind. Überhaupt sind nur drei Totalausfälle seit der Zulassung 2015 dokumentiert und es sind auch keinerlei relevante funktionsbegrenzende Faktoren wie z. B. Alterung oder Abnutzung bekannt.
Insbesondere die einwandfreie Funktion, insbesondere die Durchlässigkeit der proximalen Verbindung Ventrikelkatheter-M.scio, kann durch die Sichtbarkeit der P-Welle einfach und sicher überprüft werden. Dennoch folgt die gesamte Shuntfunktionskontrolle mit dem M.scio noch keinem standardisierten Protokoll, für dessen Entwicklung weitere klinische Erfahrungen notwendig sind. Wissenschaftliche Veröffentlichungen zu diesem Thema sind erforderlich und erwünscht.
Die Umfrage zeigt genau wie die Literatur, dass das M.scio in der Praxis eine breite Verwendung erfährt. Die wichtigste erweiterte Anwendung ist die IVD-Messung und die auf ihre basierende Optimierung der Ventileinstellung. Die IVD-Messung wird sogar im Stand-Alone-Modus durchgeführt. Die von den Anwender*innen in Eigenverantwortung durchgeführten Referenzdruckmessungen auf Genauigkeit und Driftfreiheit lassen eine solche Anwendung als berechtigt, sicher und nützlich erscheinen.
Insgesamt ist das Risiko-Nutzen Verhältnis positiv und mehr als vertretbar. Das M.scio zeigt neben seiner Anwendung zur Shunt-Funktionskontrolle ein deutliches Potential als Forschungstool, mit dem sich zukünftig auf Basis der Druckkurven und deren Feinstruktur weiterführende diagnostische und therapeutische Parameter wie z. B. die intrakranielle Compliance bestimmen oder untersuchen lassen könnten.
1. Dunn LT. Raised intracranial pressure. 2002, J Neurol Neurosurg Psychiatry. 2002;73(1):i23-7. DOI:10.1136/jnnp.73.suppl_1.
2. Huttner H. Intrakranieller Druck (ICP), S1-Leitlinie, 2018. Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. [cited 2022 Jan 12]. Available from: URL: www.dgn.org/leitlinien.
3. Le Roux P. Intracranial Pressure Monitoring and Intracranial Pressure Monitoring and Management. In: Laskowitz D, Grant G, editors. Translational Research in Traumatic Brain Injury; Boca Raton (FL): CRC Press/Taylor and Francis Group, 2016. Chapter 15.
4. Evensen KB, Eide PK. Measuring intracranial pressure by invasive, less invasive or non-invasive means: limitations and avenues for improvement. Fluids Barriers CNS. 2020 May 6;17(1):34. DOI:10.1186/s12987-020-00195-3.
5. Yu L, Kim BJ, Meng E. Chronically implanted pressure sensors: challenges and state of the field. Sensors (Basel). 2014 Oct 31;14(11):20620–20644. DOI:10.3390/s141120620.
6. Nag DS, Sahu S, Swain A, Kant S. Intracranial pressure monitoring: Gold standard and recent innovations. World J Clin Cases. 2019 Jul 6;7(13):1535-1553.
7. Kawoos U, McCarron R M, Auker CR, Chavko M. Advances in Intracranial Pressure Monitoring and Its Significance in Managing Traumatic Brain Injury. Int J Mol Sci. 2015 Dec 4;16(12):28979-28997.
8. Frischholz M, Sarmento L, Wenzel M, Aquilina K, Edwards R, Coakham HB. Telemetric implantable pressure sensor for short- and long-term monitoring of intracranial pressure. Conf Proc IEEE Eng Med Biol Soc. 2007:514.
9. Antes S, Stadie A, Muller S, Linsler S, Breuskin D, Oertel J. Intracranial Pressure-Guided Shunt Valve Adjustments with the Miethke Sensor Reservoir. World Neurosurg. 2018 Jan;109:e642-e650. DOI: 10.1016/j.wneu.2017.10.044 .
10. London Health Science Center. PROCEDURE: INSERTION OF CODMAN MICROSENSOR EVD OR INTRAPARENCHYMAL MONITOR AND SETUP OF CODMAN EXPRESS [Internet]. London: London Health Science Center; 2008 Jun 12 [Reviewed 2022 Jan 20]. Available from:
11. Pedersen SH, Lilja-Cyron A, Astrand R, Juhler M. Monitoring and Measurement of Intracranial Pressure in Pediatric Head Trauma. Front Neurol. 2020 Jan 14;10:1376. doi: 10.3389/fneur.2019.01376.
12. Eide PK, Bakken A. The baseline pressure of intracranial pressure (ICP) sensors can be altered by electrostatic discharges. Biomed Eng Online. 2011 Aug 22;10:75. doi: 10.1186/1475-925X-10-75.
13. Czosnyka M, Czosnyka Z. Origin of intracranial pressure pulse waveform. Acta Neurochir (Wien). 2020 Aug;162(8):1815-1817. doi: 10.1007/s00701-020-04424-4.
14. Turtz AR. Fiberoptic lntracranial Pressure Monitors. Intracranial Pressure Monitoring Device In: Daroff R, Aminoff M, editors. Encyclopaedia of the Neurological Sciences (Second Edition). Amsterdam et al: Academic Press; 2014.
15. Anderson RC, Kan P, Klimo P, Brockmeyer DL, Walker ML, Kestle JR. Complications of intracranial pressure monitoring in children with head trauma. J Neurosurg. 2004 Aug;101(1 Suppl):53-8. doi: 10.3171/ped.2004.101.2.0053.
16. Raboel PH, Bartek J Jr, Andresen M, Bellander BM, Romner B. Intracranial Pressure Monitoring: Invasive versus Non-Invasive Methods-A Review. Crit Care Res Pract. 2012;2012:950393. doi: 10.1155/2012/950393.
17. Pennacchietti V, Prinz V, Schaumann A, Finger T, Schulz M, Thomale UW. Single center experiences with telemetric intracranial pressure measurements in patients with CSF circulation disturbances. Acta Neurochir (Wien). 2020 Oct;162(10):2487-2497. doi: 10.1007/s00701-020-04421-7.
18. Bjornson A, Henderson D, Lawrence E, McMullan J, Ushewokunze S. The Sensor Reservoir-does it change management? Acta Neurochir (Wien). 2021 Apr;163(4):1087-1095. doi: 10.1007/s00701-021-04729-y.
19. Merkler AE, Ch'ang J, Parker WE, Murthy SB, Kamel H. The Rate of Complications after Ventriculoperitoneal Shunt Surgery. World Neurosurg. 2017 Feb;98:654-658. doi: 10.1016/j.wneu.2016.10.136.
20. Bock HC, Kanzler M, Thomale UW, Ludwig HC. Implementing a digital real-time Hydrocephalus and Shunt Registry to evaluate contemporary pattern of care and surgical outcome in pediatric hydrocephalus. Childs Nerv Syst. 2018 Mar;34(3):457-464. doi: 10.1007/s00381-017-3654-0.
21. Beuriat PA, Puget S, Cinalli G, Blauwblomme T, Beccaria K, Zerah M, Sainte-Rose C. Hydrocephalus treatment in children: long-term outcome in 975 consecutive patients. J Neurosurg Pediatr. 2017 Jul;20(1):10-18. doi: 10.3171/2017.2.PEDS16491.
22. Lalou AD, Czosnyka M, Garnett MR, Nabbanja E, Petrella G, Hutchinson PJ, Pickard JD, Czosnyka Z. Shunt infusion studies: impact on patient outcome, including health economics. Acta Neurochir (Wien). 2020 May;162(5):1019-1031. doi: 10.1007/s00701-020-04212-0.
23. Aralar A, Bird M, Graham R, Koo B, Chitnis P, Sikdar S, Shenai M. Assessment of Ventriculoperitoneal Shunt Function Using Ultrasound Characterization of Valve Interface Oscillation as a Proxy. Cureus. 2018 Feb 19;10(2):e2205. doi: 10.7759/cureus.2205.
24. Rocque BG, Lapsiwala S, Iskandar BJ. Ventricular shunt tap as a predictor of proximal shunt malfunction in children: a prospective study. J Neurosurg Pediatr. 2008 Jun;1(6):439-43. doi: 10.3171/PED/2008/1/6/439.
25. Schlosser HG, Crawack HJ, Miethke C, Knitter T, Zeiner A, Sprung C. An improved reservoir for the flushing test to diagnose shunt insufficiency. Neurosurg Focus. 2016 Sep;41(3):E14. doi: 10.3171/2016.6.FOCUS15540.
26. Boyle TP, Nigrovic LE. Radiographic evaluation of pediatric cerebrospinal fluid shunt malfunction in the emergency setting. Pediatr Emerg Care. 2015 Jun;31(6):435-40; quiz 441-3. doi: 10.1097/PEC.0000000000000462.
27. Boyle TP, Paldino MJ, Kimia AA, Fitz BM, Madsen JR, Monuteaux MC, Nigrovic LE. Comparison of rapid cranial MRI to CT for ventricular shunt malfunction. Pediatrics. 2014 Jul;134(1):e47-54. doi: 10.1542/peds.2013-3739.
28. Meulepas JM, Ronckers CM, Smets AMJB, Nievelstein RAJ, Gradowska P, Lee C, et al. Radiation Exposure From Pediatric CT Scans and Subsequent Cancer Risk in the Netherlands. J Natl Cancer Inst. 2019 Mar 1;111(3):256-263. doi: 10.1093/jnci/djy104.
29. Koueik J, Kraemer MR, Hsu D, Rizk E, Zea R, Haldeman C, Iskandar BJ. A 12-year single-center retrospective analysis of antisiphon devices to prevent proximal ventricular shunt obstruction for hydrocephalus. J Neurosurg Pediatr. 2019 Sep 6:1-10. doi: 10.3171/2019.6.PEDS1951.
30. Kombogiorgas D. Cerebrospinal Fluid Shunts. New York: Nova Science; 2016.
31. Fritsch M, Kehler U and Meier U. Normal Pressure Hydrocephalus: Pathophysiology Diagnosis Treatment. Stuttgart et al: Thieme; 2014.
32. Farahmand D, Qvarlander S, Malm J, Wikkelsö C, Eklund A, Tisell M. Intracranial pressure in hydrocephalus: impact of shunt adjustments and body positions. J Neurol Neurosurg Psychiatry. 2015 Feb;86(2):222-8. doi: 10.1136/jnnp-2014-307873.
33. D'Antona L, Craven CL, Merchan MAJ, Thompson SD, Bremner F, Thorne L, Matharu MS, Watkins LD, Toma AK. Paradoxical response of intracranial pressure to shunt valve setting adjustments. Acta Neurochir (Wien). 2020 Oct;162(10):2451-2458. doi: 10.1007/s00701-020-04462-y.
34. Ertl P, Hermann EJ, Heissler HE, Krauss JK. Telemetric Intracranial Pressure Recording via a Shunt System Integrated Sensor: A Safety and Feasibility Study. J Neurol Surg A Cent Eur Neurosurg. 2017 Nov;78(6):572-575. doi: 10.1055/s-0037-1603632.
35. Holm S, Eide PK. Impact of sampling rate for time domain analysis of continuous intracranial pressure (ICP) signals. Med Eng Phys. 2009 Jun;31(5):601-6. doi: 10.1016/j.medengphy.2008.12.001.
36. Czosnyka M, Czosnyka Z, Keong N, Lavinio A, Smielewski P, Momjian S, Schmidt EA, Petrella G, Owler B, Pickard JD. Pulse pressure waveform in hydrocephalus: what it is and what it isn't. Neurosurg Focus. 2007 Apr 15;22(4):E2. doi: 10.3171/foc.2007.22.4.3.
37. Schuhmann MU, Sood S, McAllister JP, Jaeger M, Ham SD, Czosnyka Z, Czosnyka M. Value of overnight monitoring of intracranial pressure in hydrocephalic children. Pediatr Neurosurg. 2008;44(4):269-79. doi: 10.1159/000131675.
38. Rot S, Dweek M, Gutowski P, Goelz L, Meier U, Lemcke J. Comparative investigation of different telemetric methods for measuring intracranial pressure: a prospective pilot study. Fluids Barriers CNS. 2020 Oct 17;17(1):63. doi: 10.1186/s12987-020-00225-0.
39. Norager NH, Lilja-Cyron A, Hansen TS, Juhler M. Deciding on Appropriate Telemetric Intracranial Pressure Monitoring System. World Neurosurg. 2019 Jun;126:564-569. doi: 10.1016/j.wneu.2019.03.077.
40. Thompson S. D.: Management of idiopathic intracranial hypertension: treatment options and advances. 2017, British Journal of Neuroscience Nursing. 2017 Sep 1;13(4):187-191. doi: doi.org/10.12968/bjnn.2017.13.4.187.
41. Galloway L, Karia K, White AM, Byrne ME, Sinclair AJ, Mollan SP, Tsermoulas G. Cerebrospinal fluid shunting protocol for idiopathic intracranial hypertension for an improved revision rate. J Neurosurg. 2021 Oct 8:1-6. doi: 10.3171/2021.5.JNS21821.
42. D’Antona L, Craven CL, Thompson S, Sennik S, Asif H, Mediratta S, et al. Telemetric ICP monitoring after neuroendoscopic treatment of hydrocephalus: a valuable tool to recognize treatment failure In: Abstracts from Hydrocephalus 2018: the tenth meeting of the International Society for Hydrocephalus and Cerebrospinal Fluid Disorders. Fluids Barriers CNS. 2018 Dec 24;15(Suppl 2). Doi: doi.org/10.1186/s12987-018-0119-0
43. Craven CL, Mullins SR, Asif H, D’Antona L, Thompson S, Watkins LD, Toma AK, Horsley V. CSF dynamics following endoscopic repair of anterior skull base defects In: Abstracts from Hydrocephalus 2019: The Eleventh Meeting of the International Society for Hydrocephalus and Cerebrospinal Fluid Disorders. Fluids Barriers CNS. 2019 Dec 5;16(Suppl 3). Doi: doi.org/10.1186/s12987-019-0156-3