Überdrainage bedeutet, dass zu viel Liquor abgeführt wird und ein zu niedriger intraventrikulärer Druck, teilweise sogar ein Sog in den Ventrikeln besteht.
Die äußerlich sichtbaren akuten Symptome sind weitgehend dieselben wie bei der Unterdrainage, nämlich Kopfschmerzen, Schwindel und Übelkeit. Beide Komplikationen sind daher zunächst kaum voneinander zu unterschieden.
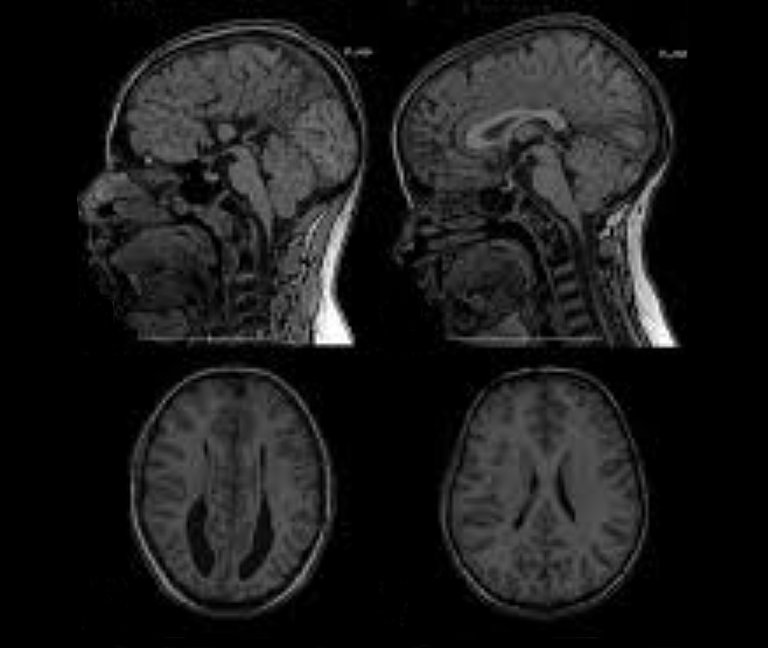
In der Bildgebung kann sich bei einer Überdrainage allerdings zeigen, dass die Ventrikel im Unterschied zur Unterdrainage geschrumpft oder sogar ganz in sich zusammengefallen sind – sie werden dann als Schlitzventrikel bezeichnet.
Schlitzventrikel für sich genommen haben zunächst keinen Krankheitswert. Der Begriff bezeichnet nur die Weite der Hirnwasserkammern, die infolge von Überdrainage schlitzförmig verengt sind. Ein solches Erscheinungsbild der Ventrikel im CT oder MRT bestätigt aber z.B. die Verdachtsdiagnose "Überdrainage".
INTRAVENTRIKULÄRER DRUCK
Der intraventrikuläre Druck (engl: Intraventricular Pressure = IVP) ist ein Differenzdruck bezogen auf den äußeren Atmosphärendruck. Ein „negativer IVP“ oder Sog liegt also dann vor, wenn der Druck in den Ventrikeln kleiner als der Luftdruck ist.
Infolge von Überdrainage wird das Hirngewebe unter eine erhebliche Spannung gesetzt, allerdings nicht durch Kompression, sondern durch eine Zug- oder Dehnungsspannung, die die Kortex-Oberfläche von der Schädelwand in Richtung Ventrikel wegzieht. Es gibt sogar dokumentierte Fälle, in denen der ganze Hirnstamm oder das Kleinhirn durch diesen Sog räumlich verschoben werden und das äußerst dünne Aquädukt (der wichtige Verbindungskanal zwischen III. und IV. Ventrikel) dabei abgeknickt wird.
Die bildgebenden Verfahren führen aber nicht immer und auch nicht sofort zu derart eindeutigen Diagnosen, sondern sind häufig unauffällig: die genannte morphologische Veränderung der Ventrikel und des Hirns benötigen einige Zeit und hängen natürlich auch von der Stärke der Überdrainage und der Compliance des Gehirns ab.
Compliance
Ein besonders wichtiger Begriff im Bereich der Hydrocephalus-Therapie ist die sogenannte „Compliance“. Sie charakterisiert nicht nur das Gehirn, sondern das gesamte Zentrale Nervensystem (ZNS), d.h. den Schädelinnenraum und den Rückenmarkskanal. Diese Räume sind überwiegend mit Hirngewebe und Rückenmark gefüllt (ca. 1400 ml) , ebenso mit arteriellem und venösem Blut (zusammen ca. 150 ml, im Verhältnis 1:2) sowie mit CSF (englisch: Cerebrospinal fluid = CSF oder auch „Liquor“ genannt: ca. 150 ml).

Anschaulich gesprochen reflektiert die Compliance etwas wie die „Weichheit“ oder „Elastizität“ des gesamten Schädel- und Spinalraumes. Diese Elastizität ist eine „Pseudo-Elastizität“, denn die Bestandteile Hirngewebe/Rückenmark, Blut und CSF sind für sich genommen inkompressibel, oder anders gesagt, „hart“. Die Compliance kommt so zustande, dass bei jeder zusätzlichen „Raumforderung“ innerhalb des harten Schädelvolumens – z.B. durch einen Aufstau von zu viel CSF (Hydrocephalus), bei einer Blutung (Hämatom) oder durch eine Geschwulst (Krebs, Zyste, Schwellung) – im Wesentlichen venöses Blut aus dem starren Raum nach außen in den Körper verdrängt wird. So steigt der Druck im Schädel (ICP = Intracranial pressure) durch solche Raumforderungen bei normaler Compliance zunächst nur wenig an, weshalb diese auch oft mit einer „Druck-Reserve-Kapazität“ assoziiert wird. Wird die Raumforderung jedoch zu groß, so ist auch die Reservekapazität bald erschöpft und der ICP steigt stark an. Eine Minderung der Compliance ergibt sich aber nicht nur durch eine zu hohe Raumforderung, sondern auch durch pathologische Verhärtung des Gewebes und der Gefäße, vor allem der Venen (Sklerose). Man sagt, die Bestimmung der Compliance hat auch einen „diagnostischen Wert“, denn man erfährt durch sie etwas über die Höhe der Raumforderung und den Zustand des Gewebes bzw. der Blutgefäße.
Die exakte medizinische Definition der Compliance als Druck-Volumen-Beziehung (C = dV/dP) ist in der folgenden Druck-Volumen-Kurve erläutert:

Eine besondere physiologische (natürliche/gesunde) Raumforderung im Schädelinnenraum ergibt sich aus dem periodischen wellenartig Einströmen des arteriellen Blutes. In der folgenden Figur wird illustriert, wie die Amplitude (d.h. die Höhe) der immer vorhandenen ICP-Pulswellen von der Compliance abhängt: hohe ICP-Wellenamplituden zeigen eine verringerte Compliance.

Zwar befinden sich nur wenige Prozent der gesamten CSF-Menge im knöchernen Spinalkanal, dafür aber umso mehr venöses Blut (d.h. Venen). Der „durale Sack“, in dem sich das spinale CSF befindet, ist dehnbar und weitet sich im Stehen durch das Absacken von CSF aus dem Schädel nach unten deutlich auf. Insgesamt trägt der Spinalkanal wahrscheinlich zu mehr als 50% zur gesamten Compliance bei.
Die Überdrainage ist nicht so einfach erklärbar wie die Unterdrainage. Wie kann ein Sog solcher Größenordnung allein durch die Shunt-Implantation entstehen, d.h. durch die künstliche Verbindung der Ventrikel mit dem (vorwiegend) Bauchraum? Der einzige Bereich im menschlichen Körper, in dem ein gewisser moderater Unterdruck (negativer Druck, Sog) herrscht, ist der Pleuraspalt (p = approx. - 5cmH2O), aber der wird als Ableitungsort für die Drainage heutzutage kaum noch in Betracht gezogen. Es gab früher auch Spekulationen über einen „dynamischen Pumpmechanismus“, z.B. bei schreienden Kindern, die sich aber nicht bestätigen ließen.
Eine plausible hinreichende Erklärung findet sich jedoch im sogenannten hydrostatischen Druck (englisch: Hydrostatic Pressure = HSP). Dieser tritt ausschließlich – dann aber zwangsläufig – in stehender Position des Patienten auf und wird durch das Gewicht der sich im Shunt (d.h. vor allem im langen Peritoneal-Katheter) befindlichen Flüssigkeitssäule hervorgerufen. Am unteren Ende des Katheters macht sich dieses Gewicht als Gewichtsdruck der Flüssigkeitssäule bemerkbar, am oberen Ende aber als Sog das ist der hydrostatische Druck (HSP), bzw. je nach Referenzpunkt, hydrostatische Sog. Ohne Ventil läuft die Flüssigkeitssäule einfach aus dem oben und unten offenen Katheter heraus, wobei dieser Vorgang durch das Gewicht der Flüssigkeit getrieben wird. Mit anderen Worten: wenn der Patient aufrecht steht und die obenliegenden Ventrikel über den langen Katheter mit dem untenliegenden Bauchraum verbunden sind, „möchten“ sich diese vollständig entleeren. Man kann das auch so ausdrücken, dass sie „leergesaugt“ werden, weshalb dieser Effekt häufig mit dem Begriff „Siphoning“ bezeichnet wird. Dieser extreme Fall würde allerdings nur dann eintreten, wenn Luft von außen in die Ventrikel nachströmen könnte. Da die Ventrikel aber normalerweise geschlossen sind, fließt nur so viel Liquor ab, bis der hydrostatische Sog durch eine im Hirngewebe entstehende Zugspannung („Gegensog“) ausgeglichen wird: wieviel das im Einzelfall ist, hängt u.a. von der Elastizität des Gewebes (Compliance) und von der Größe des Soges ab.
Hydrostatischer Druck in cmH2O
Der Druck im Liquor cerebrospinalis wird im medizinischen Fachjargon in der nicht-SI-Einheit („SI“ steht dabei für Système international d’unités und bezeichnet das internationale Einheitssystem für physikalische Größen) cmH2O ausgedrückt - gesprochen: „Zentimeter-Wassersäule“. Es ist ein sogenannter Differenzdruck, der den Druckunterschied (d.h. die Druckdifferenz) zwischen Schädelinnerem und äußerem Luftdruck beschreibt.
Ein cmH2O ist definiert als der hydrostatische Druck, den eine Wassersäule von einem Zentimeter Höhe bei einer Dichte von exakt einem Gramm pro Kubikzentimeter Wasser bewirkt. Anders als bei der für Druck üblichen Einheit Pa - gesprochen: „Pascal“ - die definiert ist als die Kraft eines Newtons, die auf eine Fläche von einem Quadratmeter wirkt, handelt es sich bei der Einheit cmH2O um eine Größe, die ganz ohne Wirkfläche auskommt. Sie bezieht sich lediglich auf ein eindimensionales Längenmaß, nämlich die Höhe der Wassersäule, die auf dem betrachteten Druckpunkt lastet. Dies entspricht nicht unserem intuitiven Verständnis von Druck, verdeutlicht dafür jedoch umso mehr die Wirkung des hydrostatischen Drucks – also dem Druck in einem Medium (z.B. in einer Flüssigkeit), der durch das Eigengewicht dieses Mediums selbst hervorgerufen wird. In anderen Worten: der Druck entsteht, weil das Medium mit seinem eigenen Gewicht auf sich selber drückt.
Ein cmH2O entspricht in etwa einem Millibar oder in SI-Einheiten ausgedrückt: tausend Pascal.
Der Hydrostatische Druck wird nach der Formel:
HSP = rho * g * h
berechnet. Dabei ist h die Höhe der Flüssigkeitssäule und rho und g physikalische Konstanten.
Bei einem durchschnittlichen Erwachsenen kann somit ohne Weiteres einen Sog von - 50 cmH2O erreicht werden. Dass die Verjüngung der Ventrikel die genannte starke Zugspannung erzeugt, liegt daran, dass das Gehirn an seiner Außenseite fest mit dem Schädel verbunden ist und daher nicht insgesamt „schrumpfen“ kann.
Dieser physikalischen Formel gemäß verschwindet dieser Effekt in liegender Position, denn die Höhe der Säule beträgt hier ja h = 0 cm, also auch HSP = 0. Das ist auch anschaulich ganz plausibel, denn die Flüssigkeitssäule im „liegenden“ (horizontalen) Katheter wird jetzt nicht mehr durch ihr Eigengewicht seitlich aus den Katheter-Enden herausgepresst. Mit anderen Worten: mit dem Bauchraum verbundene Ventrikel werden im Liegen auch nicht mehr leergesaugt. Der „Siphon-Effekt“ ist in dieser Lage nicht mehr vorhanden.
Es sei an dieser Stelle nochmal betont, dass dieser physikalische Effekt IMMER und UNVERMEIDLICH im Stehen auftritt, und – je nach Größe des Patienten bzw. je nach Abstand der Ventrikel vom Zwerchfell – einen massiven Sog von 20 - 60 cmH2O erzeugt. Dieser ist dann ohne Weiteres in der Lage, die oben beschriebenen Symptome wie Schlitzventrikel und sogar die räumliche Verschiebung von ganzen Hirnteilen hervorzurufen. Aus dieser rein physikalischen Erklärung wird auch klar, dass im Unterschied zur Unterdrainage, die an sich ganz ähnlichen Überdrainagesymptome NUR im Stehen auftreten, im Liegen aber relativ rasch wieder abklingen. Dies bietet ein gutes diagnostisches Unterscheidungskriterium zwischen beiden Phänomenen.
Das kritische Problem bei der Überdrainage ist also nicht primär der niedrige, intraventrikuläre Druck, sondern die Tatsache, dass durch die Dehnung des Hirngewebes die Bildung von Hygromen und Hämatomen, d.h. flüssigkeits- und blutgefüllten Hohlräumen vor allem zwischen Hirn-Oberfläche und Schädel gefördert wird. Das Gehirn ist über die fein-strukturierte sogenannte „Spinngewebshaut“ (Arachnoidea) und die Dura-Mater fest mit dem Schädel verbunden und kann sich normalerweise nicht von diesem lösen. Entsteht nun ein zu großer Sog nach innen, also von der Schädelwand weg, ist es zuerst diese feine Haut und die in ihr verlaufenden dünnen Brückenvenen, die reißen und einbluten. Es können aber auch große venöse Sinusgefäße in der Dura oder Arterien verletzt werden. Durch die Überdrainage werden fast ausschließlich sogenannte "Subdurale Hämatome" (SDH) hervorgerufen und diese können sogar chronisch werden. Laborexperimente belegen eindrucksvoll wie ein typischer hydrostatischer Sog in den Ventrikeln von ca. - 30 cmH2O an den fixierten äußeren Hirnhäuten Kräfte von mehreren hundert Gramm (Gewichtsäquivalent) hervorrufen kann. In dem beschriebenen Szenario ist es klar, dass Überdrainage-Hämatome sogar chronisch werden können (cSDH = chronical subdural haematoma).
Ein anderes durch die Überdrainage induziertes und ebenso gravierendes Problem ist das sogenannte Schlitzventrikelsyndrom (SVS). Durch das sog-induzierte Zusammenziehen der Ventrikel können die feinen Öffnungen des Ventrikelkatheters (VK) verschlossen werden. Der Liquor kann dann nicht mehr abgeführt werden und die Ventrikel weiten sich wieder. Wird der Sog danach erneut wirksam, beginnt der Prozess von vorne. Diese periodische, mit starken Spannungen verbundene Kontraktion und Expansion der Ventrikel kann das Gewebe bereits schädigen. Wächst dann noch Gewebe in die kleinen Katheterlöcher ein, kann dies bei der nachfolgenden Ventrikelexpansion zu weiteren Geweberissen und Blutungen führen. Wenn der Ventrikelkatheter dabei irreversibel verstopft wird, bleiben die Ventrikel eng und eine Shunt-Revision wird unvermeidlich. Rolf Gruber hat diese Phase des SVS bereits 1987 folgendermaßen beschrieben:
„Bei der Shuntrevision lässt sich der fixierte Ventrikelkatheter nur mühsam entfernen, sein Lumen ist durch inkarzerierte Gewebspfröpfe in den Ostien komplett oder partiell verlegt. Sie bestehen aus vaskularisierter Neuroglia, Plexusanteilen und Blutkoageln. Ependymzellen werden nur an den abgerissenen Gewebsfragmenten außerhalb, jedoch nie innerhalb des Katheters gefunden.“ [Gruber3, Das Schlitz-Ventrikel-Syndrom, 1987].
Viele Autor*innen gehen bis heute davon aus, dass diese nachweislichen Verletzungen des Ependyms durch chronische Überdrainge (d.h. nicht nur bei Kindern) zu einer dauerhaften Versteifung/Verhärtung der Ventrikelwände und einer damit einhergehenden erniedrigten Hirncompliance führen („stiff ventricles“). Für diese Hypothese spricht, dass die Ventrikel nach einer Wiederherstellung physiologischer, d.h. „normaler“ Druckverhältnisse nicht unbedingt zu ihrer ursprünglichen Ventrikelweite zurückkehren [Pollay4 1994, Ros5 2018, Wagner6 2018]. Untersuchungen des Beitrages pathologischer Zellveränderungen zu dieser mutmaßlichen Ventrikelversteifung haben jedoch bisher keine endgültige Klarheit schaffen können [Oi91986, Del Bigio7 2002, Di Rocco8 2015, ].