“A shunt was considered infected if the patient showed clinical signs of wound infection, septicemia in patients with ventriculoatrial shunts, peritonitis in patients with ventriculoperitoneal shunts, or meningitis and if bacteria were cultivated from blood, peritoneum, cerebrospinal fluid, or the shunt system. An acute infection was an infection causing symptoms and/or positive bacteriological cultures within the first four postoperative weeks. If the same criteria were fulfilled more than one month postoperatively it was registered as a late infection.”
["Ein Shunt galt als infiziert, wenn die Patient*innen klinische Anzeichen einer Wundinfektion, einer Septikämie bei Patient*innen mit ventrikuloatrialen Shunts, einer Peritonitis bei Patient*innen mit ventrikuloperitonealen Shunts oder einer Meningitis aufwiesen und wenn Bakterien aus Blut, Peritoneum, Liquor oder dem Shuntsystem kultiviert wurden. Eine akute Infektion war eine Infektion, die Symptome und/oder positive bakteriologische Kulturen innerhalb der ersten vier postoperativen Wochen verursachte. Wenn dieselben Kriterien mehr als einen Monat postoperativ erfüllt waren, wurde dies als Spätinfektion registriert.“]
Einige typische und häufige Symptome sind Fieber, Schmerzen sowie Rötung und Schwellung der betroffenen Körperstellen, soweit es sich um lokale Infektionen handelt. Allerdings muss hier betont werden, dass eine Shunt-Infektion keineswegs immer einfach und eindeutig zu diagnostizieren ist. Im Rahmen der großen aktuellen BASICS-Studie aus dem Jahr 2019, auf die in diesem Artikel noch mehrfach eingegangen wird, wurde das Vorliegen oder Nichtvorliegen einer Infektion von einem (verblindeten) Expert*innen-Gremium ("central primary outcome review panel") anhand eines umfangreichen, von Mallucci et al. beschriebenen Kriterienkatalogs bewertet [5; 6].
“These infections (of a cerebrospinal fluid shunt) may be difficult to diagnose because changes in cerebrospinal fluid parameters are often subtle, making it hard to determine if the abnormalities are related to infection, related to placement of devices, or following neurosurgery.”
["Diese Infektionen (eines Liquor-Shunts) können schwer zu diagnostizieren sein, weil die Veränderungen der Liquor-Parameter oft subtil sind, so dass es schwierig ist, festzustellen, ob die Anomalien mit einer Infektion, mit dem Einsetzen der Geräte oder mit einem neurochirurgischen Eingriff zusammenhängen.]
Obwohl sie oft schwer mit Sicherheit zu diagnostizieren sind, gehören Shunt-Infektionen jedoch zu den häufigsten Komplikationen bei Shunt-Operationen. In einer 2018 von Bock et al. durchgeführten umfassenden Datenbankanalyse zur Shunttherapie in zwei großen deutschen Krankenhäusern [8] rangiert das Infektionsrisiko als Revisionsgrund an vierter Stelle, hinter Kathetermigration, Obstruktion und unbekannten/unbestimmten Gründen. Diese Auswertung basiert auf 256 pädiatrischen Fällen, die im Median 8,5 Jahre lang nachbeobachtet wurden. Bei dieser Analyse fällt auf, dass Revisionen (d.h. die Explantation des Shunts) aufgrund von Infektionen überwiegend in den ersten 12 Monaten auftraten. In einer weiteren Auswertung der großen "UK-Shunt-Registry"-Daten, die 41.036 Eingriffe bei 26.545 Patient*innen umfassten, fanden Fernández-Méndez et al. [9] heraus, dass Shunt-Infektionen in ihrem zehnjährigen Studienzeitraum der zweithäufigste Grund für primäre Shuntrevisionen waren („primär“ bedeutet hier, dass nur Shunts betrachtet wurden, die für die Patient*innen ihre ersten waren).
Zu diesem Ergebnis kommt auch die besonders umfangreiche Meta-Analyse von Isaacs et al. aus dem Jahr 2023, die auf 38.095 Shunt-Implantationen bei Erwachsenen beruht [2]: Infektionen sind die zweithäufigste Komplikation nach Obstruktionen und sind Ursache für 22,5% aller Revisionen.
Da Infektionen offensichtlich mit zu den häufigsten und schwerwiegendsten Komplikationen seit der Einführung der Shunt-Therapie gehören, gibt es eine große Anzahl weiterer Studien, die die Infektionsraten in Abhängigkeit von unterschiedlichen Faktoren dokumentieren. Einige typische Einflussfaktoren sind: unterschiedliche Altersgruppen und Ätiologien der Patient*innen, Anzahl der Shunt-Implantationen/Revisionen pro Patient*in, unterschiedliche Krankenhausinfrastrukturen, praktische Erfahrung der Chirurg*innen, angewandte Protokolle und Einhaltung der Protokolle. Dementsprechend weisen diese Zahlen eine enorme Bandbreite auf. In einer sehr frühen Langzeitstudie von George et al. wird diese große Bandbreite und ihre Entwicklung von 1952 bis 1976 (25 Jahre) eindrucksvoll dargestellt [11].
Diese frühe Studie basiert auf 840 Operationen ("Eingriffen") bei 410 Patient*innen aller Altersgruppen. Die wichtigsten, allgemeinen Fakten zu Shunt-Infektionen wurden bereits in dieser Publikation festgehalten:
- In den Anfängen der Shunttherapie in den 1950er Jahren waren Infektionsraten von über 35% möglich.
- Seitdem ist die Infektionsrate deutlich und kontinuierlich zurückgegangen.
- Insbesondere die infektionsbedingte Sterblichkeit ging von 35% auf 6% (1976) zurück.
- Bei der überwiegenden Mehrheit der Infektionen handelt es sich um sogenannte "Frühinfektionen", die innerhalb des ersten Monats nach der Implantation auftreten, in diesem Fall bei zwei Dritteln aller Infektionen [11].
- Höhere Infektionsraten treten bei sehr jungen Patient*innen (< 1 Jahr) auf, bei denen das Immunsystem noch schwach ist.
- Bei "Follow-up-Shunts", d. h. nicht primären Shunts, treten vergleichsweise höhere Infektionsraten auf.
- Es wurde eine 25-fache Varianz der Infektionsraten zwischen verschiedenen Chirurg*innen festgestellt, die u.a. auf deren individuelle Erfahrung und Technik zurückzuführen ist.
- Mehr als 60% der Infektionen werden durch den Erreger Staphylococcus verursacht, vor allem Staphylococcus epidermis, aber auch Staphylococcus aureus.
Diese grundlegenden Fakten wurden in späteren Studien immer wieder bestätigt:
- Die Dominanz von "frühen Infektionen" (im Gegensatz zu "späten Infektionen") wurde von mehreren Studien bestätigt [4; 8; 10]: Besonders erwähnenswert ist dabei die 2017 durchgeführten Analyse der Daten des "UK shunt registry" von Pickard et al. [10] (siehe https://www.sbns.org.uk/index.php/audit/shunt-registry/ ). Basierend auf einem großen Datensatz von 53.767 Operationen bei 29.341 Patient*innen, wurde der zeitliche Verlauf des Auftretens der verschiedenen möglichen Shunt-Komplikationen über 6 Jahre erfasst und verglichen (siehe Abbildung 4). Diese Studie zeigt deutlich, dass die überwiegende Mehrheit der Infektionen sehr früh (in den ersten 4 Wochen) auftritt.

- Die erhöhte Gefährdung von Kindern und Neugeborenen, insbesondere von Frühgeborenen, wurde auch später wiederholt nachgewiesen [12; 13; 14; 15; 16].
- Schließlich wird auch mehrfach die Vermutung geäußert, dass die Erfahrung des/der Chirurg*in einen wesentlichen Einfluss auf die Infektionsraten hat. Der hilfreiche Einfluss des/der erfahrenen Neurochirurg*in könnte entweder durch eine Verkürzung der Operationszeit, aber möglicherweise auch durch eine Änderung des Verhaltens aller Beteiligten bei der Einhaltung des Hygieneprotokolls wirksam werden [4; 13; 14; 16; 17; 18].
Neben den oben genannten Punkten werden in den größeren Studien und Übersichtsarbeiten immer wieder die folgenden Risikofaktoren genannt [12; 13; 15; 16; 19; 20; 21]:
- frühere Shunt-Revisionen
- bestimmte Ätiologien des Hydrocephalus, insbesondere nach früheren Infektionen und intraventrikulären Blutungen (IVH= intraventricular hemorrhage), Myelomeningozele, Kinder mit bösartigen Erkrankungen, bei chemotherapiebedingter Immunsuppression, nach langfristiger Anwendung von Steroiden oberhalb der Cushing-Schwelle
- Patient*innen mit postoperativem Liquor-Leck, da dieses eine Eintrittspforte für Bakterien darstellt
Ein interessantes Ergebnis einer großen weltweiten ISPN (International Society For Pediatric Neurosurgery)-Umfrage zu neurochirurgischen Praktiken bei der Behandlung von Shunt-Infektionen aus dem Jahr 2020 sollte hier ebenfalls erwähnt werden: Diese Umfrage zeigte ein signifikant geringeres Risiko für Shunt-Infektionen in Krankenhäusern mit besonders hohen pädiatrischen Fallzahlen [22]. Der Hintergrund hierfür ist bisher nicht verstanden. Möglich wäre aber, dass die weiter oben angeführte höhere klinische Erfahrung in solchen Krankenhäusern eine ausschlaggebende Rolle spielt.
Infektionsraten heute
Seit den 2020er Jahren wird von mehreren Autor*innen eine Spanne zwischen 5% und 17% für mögliche Infektionsraten angegeben [5; 9; 23].
In der umfangreichen prospektiven BASICS-Studie [5] (siehe Kapitel 3), wurde bei 536 Patient*innen unterschiedlichen Alters und unterschiedlicher Ätiologie eine mittlere Infektionsrate von 6% festgestellt, wobei Standard-Katheter verwendet wurden, allerdings nur für primäre Shunts. In dieser Studie wurden zusätzlich ergriffene, spezielle Maßnahmen zur Infektionsvorbeugung nach dem Zufallsprinzip verteilt (da dies ausschließlich in der Verantwortung des/der Chirurg*in lag), so dass die angegebenen 6% tatsächlich einen "Mittelwert" für primäre Shunts über alle Altersgruppen darstellen.
In der bereits erwähnten weltweiten ISPN-Umfrage 2020 berichten Behbahani et al., dass 64% der Befragten eine Infektionsrate von weniger als 5% aufweisen, während 22% der Befragten Infektionsraten von 5-10% in der pädiatrischen Patient*innen-Gruppe erwähnen [22].
In Übereinstimmung damit wurden auch in der Studie von Chu et al. [24] auf der Grundlage von 4.913 Eingriffen in 13 HCRN-Zentren des "Hydrocephalus Clinical Research Network" (HCRN) durchschnittliche Infektionsraten für Kinder von 5,1% gefunden, mit einer Varianz von 2,2% bis 9,3% pro Zentrum. Und schließlich berichten Shibamura-Fujiogi et al. auf der Grundlage von 558 Eingriffen ähnliche Werte, nämlich 4,3%. [25].
Dieser allgemeine Rückgang der Infektionsraten - im Vergleich zu früheren Zahlen - zeigt, dass die Sensibilisierung für Risikofaktoren und die Umsetzung von Maßnahmen zu ihrer Verringerung bereits erfolgreich waren. Gleichzeitig zeigt die große Varianz zwischen den Zentren, dass ein standardisierter, evidenzbasierter Ansatz für Patient*innen und Gesundheitssysteme von Vorteil sein könnte.
Wie eine Shunt-Infektion entsteht
Um Shunt-Infektionen gezielt bekämpfen zu können, ist ein Verständnis der Ursachen und des Verlaufs unabdingbar. Wegen der Dominanz der Frühinfektionen innerhalb der ersten 4 Wochen scheint es offensichtlich, dass zumindest diese Infektions-Art intraoperativ verursacht wird [16; 26]. Diese Annahme wird weiter gestützt durch die Art der überwiegend gefundenen Keime bei Frühinfektionen, bei denen es sich häufig um auf der Haut vorkommende Bakterien handelt. Diese Bakterien finden sich in der normalen Hautflora, wie z. B. koagulasenegative Staphylokokken (CoNS), z. B. Staphylococcus epidermidis und Staphylococcus aureus [4; 14; 26]. CoNS sind für 50% und Staphylococcus aureus für 33% aller Shunt-Infektionen verantwortlich [26].

Die umfangreichen Daten der BASICS-Studie wurden auch hinsichtlich der verursachenden Keime analysiert, was zu ähnlichen Ergebnissen wie denen von Wells et al. führte. Zusätzlich wurden die in dieser Auswertung gefundenen Erreger anhand der Gram-Färbung klassifiziert, da diese für die Auswahl möglicher Antibiotika entscheidend ist [5; 6] (siehe auch die "Nerdbox"):
- grampositive Bakterien machen etwa
73% aller Shunt-Infektionen aus - gramnegative Bakterien machen
etwa 20% aller Shunt-Infektionen aus - Infektionen mit gemischten grampositiven
und gramnegativen Bakterien machen
etwa 7% der gesamten Shunt-Infektionen aus
Die Kontamination des Implantats erfolgt entweder durch direkten Kontakt mit der Haut der Patient*innen oder einer der anwesenden Personen. Nach der Besetzung des Implantats haften die Erreger schnell an der Oberfläche des Biomaterials und entwickeln Strategien, um sowohl dem Immunsystem als auch einer möglichen antibiotischen Behandlung zu entgehen [27]. Hautbegleitkeime wie Staphylokokken heften sich an die Silikonoberfläche des Shuntkatheters, wo sie sich zu vermehren beginnen. Aufgrund des lebensfeindlichen Milieus im Liquor, mit niedrigem Eisengehalt und unzureichenden Kohlenstoff- und Stickstoffquellen, erfolgt diese Vermehrung langsam, aber stetig [14]. Grampositive Bakterien wie CoNS und Staphylococcus aureus treten in der Regel in Clustern auf und neigen zur Bildung sogenannter Biofilme, mit denen sie sich effektiv an Implantatmaterialien anheften können. Interessanterweise betraf der erste Bericht über einen solchen Biofilm im Jahr 1972 eine Shunt-Infektion [28].
Die Entwicklung eines Biofilms schützt das weitere Wachstum der Bakterien und erschwert die antibiotische Behandlung erheblich. Im Allgemeinen sind Biofilme Gruppen von Mikroorganismen, die an biotischen oder abiotischen Oberflächen haften und von einer Matrix umgeben sind, die aus einer extrazellulären polymeren Substanz (EPS) besteht, die extrazelluläre DNA, Proteine und Polysaccharide enthält. Diese Biofilme wirken als physische Barrieren gegen die Immunantwort des Körpers und ebenso gegen Medikamente [29]. Wenn sich die Bakterien an der Katheteroberfläche festsetzen und einen Biofilm entwickeln, ändern sie zudem ihren Stoffwechsel, um Energie zu sparen. Dieser Zustand wird als "Ruhezustand" bezeichnet und reduziert die Zahl vieler metabolischer Angriffspunkte für gängige Antibiotika, wodurch diese weniger wirksam sind [30; 31]. Wegen der verringerten Durchlässigkeit des Biofilms und der bakteriellen Ruhephase sind viel höhere - oft inakzeptabel hohe - Konzentrationen von Antibiotika erforderlich, um die Bakterien wirksam zu bekämpfen [14].
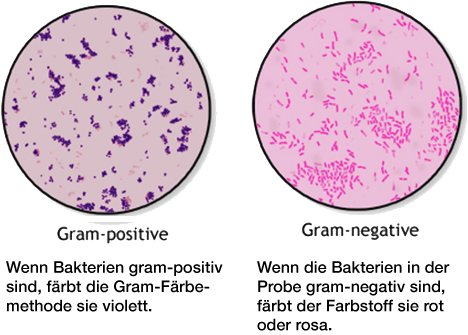
grampositive und gramnegative Bakterien
Infektionen können durch verschiedene Erreger wie Pilze, Parasiten, Algen, Viren, Prionen oder Bakterien verursacht werden. Die Bakterien können weiter nach ihrer Form unterteilt werden: kugelförmig (Kokken), stäbchenförmig (Bazillen), spiralförmig (Spirillen), kommaförmig (Vibrios) oder korkenzieherförmig (Spirochaeten). Sie können als einzelne Zellen, in Paaren, Ketten oder Clustern vorkommen.
Eine weitere Differenzierungsmethode ist die so genannte Gram-Färbemethode, benannt nach dem dänischen Bakteriologen Hans Christian Gram. Sie ist eine der wichtigsten Färbetechniken in der Mikrobiologie und in der Regel der erste Test, der zur Identifizierung von Bakterien durchgeführt wird. Die Gram-Färbung unterscheidet Bakterien anhand der chemischen und physikalischen Eigenschaften ihrer Zellwände in Gramnegativ und Grampositiv. Die Methode besteht aus einer Reihe von Färbe- und Entfärbungsschritten. Gramnegative Zellen färben sich rot bis rosa, Grampositive Zellen färben sich blau bis violett.
(https://www.cdc.gov/labtraining/docs/job_aids/routine_microscopy_procedures/Gram-Stain_508.pdf)
Der Unterschied in der Gram-Färbbarkeit ist auf die unterschiedliche Struktur der Zellwände der Bakterien zurückzuführen. Die Gram-Färbung ist wichtig für die Diagnose und vor allem Behandlung von Infektionskrankheiten. Grampositive und Gramnegative Bakterien können oft nur mit unterschiedlichen Antibiotika bekämpft werden.