Shunt-Infektion: Wie sie entsteht und wie sie verhindert werden kann
Vorwort
Bis heute ist die Implantation eines Shunts die häufigste Behandlungsform des Hydrocephalus [2; 3]. Obwohl es sich um ein relativ einfaches und routinemäßiges Verfahren handelt, erfordert die Implantation eines Shuntsystems dennoch die Einbringung von Fremdmaterial in den Körper: Katheter, Ventil(e) und optionale Komponenten wie Reservoirs werden "subkutan" (d. h. unter die Haut) implantiert. Dementsprechend ist eine Hydrocephalus-Shunt-Therapie (auch) unvermeidlich mit einem Infektionsrisiko verbunden.
mehr lesenDieser Artikel befasst sich ausführlich mit Infektionen als einer häufigen und schwerwiegenden "Nebenwirkung" bei der Hydrocephalus-Shunt-Implantation, d.h. mit ihrer Bedeutung für Patient*innen und das Gesundheitssystem, ihrer Entstehung und Entwicklung, ihren Auswirkungen und den aktuellen Möglichkeiten zur Prävention. Der Artikel dient auch dazu, einen ausgewählten Überblick über die umfangreiche Literatur zu diesem Thema zu geben und den aktuellen Wissensstand so weit wie möglich darzustellen. Insbesondere haben wir versucht, umfassende Studien mit großen Fallzahlen und sogenannte „Metareviews“ oder Leitlinien, soweit vorhanden, zu bevorzugen. Wir haben weiterhin versucht, ältere und aktuelle Studien zu vergleichen, um die Entwicklung im Laufe der Zeit aufzuzeigen.

“A shunt was considered infected if the patient showed clinical signs of wound infection, septicemia in patients with ventriculoatrial shunts, peritonitis in patients with ventriculoperitoneal shunts, or meningitis and if bacteria were cultivated from blood, peritoneum, cerebrospinal fluid, or the shunt system. An acute infection was an infection causing symptoms and/or positive bacteriological cultures within the first four postoperative weeks. If the same criteria were fulfilled more than one month postoperatively it was registered as a late infection.”
["Ein Shunt galt als infiziert, wenn die Patient*innen klinische Anzeichen einer Wundinfektion, einer Septikämie bei Patient*innen mit ventrikuloatrialen Shunts, einer Peritonitis bei Patient*innen mit ventrikuloperitonealen Shunts oder einer Meningitis aufwiesen und wenn Bakterien aus Blut, Peritoneum, Liquor oder dem Shuntsystem kultiviert wurden. Eine akute Infektion war eine Infektion, die Symptome und/oder positive bakteriologische Kulturen innerhalb der ersten vier postoperativen Wochen verursachte. Wenn dieselben Kriterien mehr als einen Monat postoperativ erfüllt waren, wurde dies als Spätinfektion registriert.“]
Einige typische und häufige Symptome sind Fieber, Schmerzen sowie Rötung und Schwellung der betroffenen Körperstellen, soweit es sich um lokale Infektionen handelt. Allerdings muss hier betont werden, dass eine Shunt-Infektion keineswegs immer einfach und eindeutig zu diagnostizieren ist. Im Rahmen der großen aktuellen BASICS-Studie aus dem Jahr 2019, auf die in diesem Artikel noch mehrfach eingegangen wird, wurde das Vorliegen oder Nichtvorliegen einer Infektion von einem (verblindeten) Expert*innen-Gremium ("central primary outcome review panel") anhand eines umfangreichen, von Mallucci et al. beschriebenen Kriterienkatalogs bewertet [5; 6].
“These infections (of a cerebrospinal fluid shunt) may be difficult to diagnose because changes in cerebrospinal fluid parameters are often subtle, making it hard to determine if the abnormalities are related to infection, related to placement of devices, or following neurosurgery.”
["Diese Infektionen (eines Liquor-Shunts) können schwer zu diagnostizieren sein, weil die Veränderungen der Liquor-Parameter oft subtil sind, so dass es schwierig ist, festzustellen, ob die Anomalien mit einer Infektion, mit dem Einsetzen der Geräte oder mit einem neurochirurgischen Eingriff zusammenhängen.]
Obwohl sie oft schwer mit Sicherheit zu diagnostizieren sind, gehören Shunt-Infektionen jedoch zu den häufigsten Komplikationen bei Shunt-Operationen. In einer 2018 von Bock et al. durchgeführten umfassenden Datenbankanalyse zur Shunttherapie in zwei großen deutschen Krankenhäusern [8] rangiert das Infektionsrisiko als Revisionsgrund an vierter Stelle, hinter Kathetermigration, Obstruktion und unbekannten/unbestimmten Gründen. Diese Auswertung basiert auf 256 pädiatrischen Fällen, die im Median 8,5 Jahre lang nachbeobachtet wurden. Bei dieser Analyse fällt auf, dass Revisionen (d.h. die Explantation des Shunts) aufgrund von Infektionen überwiegend in den ersten 12 Monaten auftraten. In einer weiteren Auswertung der großen "UK-Shunt-Registry"-Daten, die 41.036 Eingriffe bei 26.545 Patient*innen umfassten, fanden Fernández-Méndez et al. [9] heraus, dass Shunt-Infektionen in ihrem zehnjährigen Studienzeitraum der zweithäufigste Grund für primäre Shuntrevisionen waren („primär“ bedeutet hier, dass nur Shunts betrachtet wurden, die für die Patient*innen ihre ersten waren).
Zu diesem Ergebnis kommt auch die besonders umfangreiche Meta-Analyse von Isaacs et al. aus dem Jahr 2023, die auf 38.095 Shunt-Implantationen bei Erwachsenen beruht [2]: Infektionen sind die zweithäufigste Komplikation nach Obstruktionen und sind Ursache für 22,5% aller Revisionen.
Da Infektionen offensichtlich mit zu den häufigsten und schwerwiegendsten Komplikationen seit der Einführung der Shunt-Therapie gehören, gibt es eine große Anzahl weiterer Studien, die die Infektionsraten in Abhängigkeit von unterschiedlichen Faktoren dokumentieren. Einige typische Einflussfaktoren sind: unterschiedliche Altersgruppen und Ätiologien der Patient*innen, Anzahl der Shunt-Implantationen/Revisionen pro Patient*in, unterschiedliche Krankenhausinfrastrukturen, praktische Erfahrung der Chirurg*innen, angewandte Protokolle und Einhaltung der Protokolle. Dementsprechend weisen diese Zahlen eine enorme Bandbreite auf. In einer sehr frühen Langzeitstudie von George et al. wird diese große Bandbreite und ihre Entwicklung von 1952 bis 1976 (25 Jahre) eindrucksvoll dargestellt [11].
Diese frühe Studie basiert auf 840 Operationen ("Eingriffen") bei 410 Patient*innen aller Altersgruppen. Die wichtigsten, allgemeinen Fakten zu Shunt-Infektionen wurden bereits in dieser Publikation festgehalten:
- In den Anfängen der Shunttherapie in den 1950er Jahren waren Infektionsraten von über 35% möglich.
- Seitdem ist die Infektionsrate deutlich und kontinuierlich zurückgegangen.
- Insbesondere die infektionsbedingte Sterblichkeit ging von 35% auf 6% (1976) zurück.
- Bei der überwiegenden Mehrheit der Infektionen handelt es sich um sogenannte "Frühinfektionen", die innerhalb des ersten Monats nach der Implantation auftreten, in diesem Fall bei zwei Dritteln aller Infektionen [11].
- Höhere Infektionsraten treten bei sehr jungen Patient*innen (< 1 Jahr) auf, bei denen das Immunsystem noch schwach ist.
- Bei "Follow-up-Shunts", d. h. nicht primären Shunts, treten vergleichsweise höhere Infektionsraten auf.
- Es wurde eine 25-fache Varianz der Infektionsraten zwischen verschiedenen Chirurg*innen festgestellt, die u.a. auf deren individuelle Erfahrung und Technik zurückzuführen ist.
- Mehr als 60% der Infektionen werden durch den Erreger Staphylococcus verursacht, vor allem Staphylococcus epidermis, aber auch Staphylococcus aureus.
Diese grundlegenden Fakten wurden in späteren Studien immer wieder bestätigt:
- Die Dominanz von "frühen Infektionen" (im Gegensatz zu "späten Infektionen") wurde von mehreren Studien bestätigt [4; 8; 10]: Besonders erwähnenswert ist dabei die 2017 durchgeführten Analyse der Daten des "UK shunt registry" von Pickard et al. [10] (siehe https://www.sbns.org.uk/index.php/audit/shunt-registry/ ). Basierend auf einem großen Datensatz von 53.767 Operationen bei 29.341 Patient*innen, wurde der zeitliche Verlauf des Auftretens der verschiedenen möglichen Shunt-Komplikationen über 6 Jahre erfasst und verglichen (siehe Abbildung 4). Diese Studie zeigt deutlich, dass die überwiegende Mehrheit der Infektionen sehr früh (in den ersten 4 Wochen) auftritt.

- Die erhöhte Gefährdung von Kindern und Neugeborenen, insbesondere von Frühgeborenen, wurde auch später wiederholt nachgewiesen [12; 13; 14; 15; 16].
- Schließlich wird auch mehrfach die Vermutung geäußert, dass die Erfahrung des/der Chirurg*in einen wesentlichen Einfluss auf die Infektionsraten hat. Der hilfreiche Einfluss des/der erfahrenen Neurochirurg*in könnte entweder durch eine Verkürzung der Operationszeit, aber möglicherweise auch durch eine Änderung des Verhaltens aller Beteiligten bei der Einhaltung des Hygieneprotokolls wirksam werden [4; 13; 14; 16; 17; 18].
Neben den oben genannten Punkten werden in den größeren Studien und Übersichtsarbeiten immer wieder die folgenden Risikofaktoren genannt [12; 13; 15; 16; 19; 20; 21]:
- frühere Shunt-Revisionen
- bestimmte Ätiologien des Hydrocephalus, insbesondere nach früheren Infektionen und intraventrikulären Blutungen (IVH= intraventricular hemorrhage), Myelomeningozele, Kinder mit bösartigen Erkrankungen, bei chemotherapiebedingter Immunsuppression, nach langfristiger Anwendung von Steroiden oberhalb der Cushing-Schwelle
- Patient*innen mit postoperativem Liquor-Leck, da dieses eine Eintrittspforte für Bakterien darstellt
Ein interessantes Ergebnis einer großen weltweiten ISPN (International Society For Pediatric Neurosurgery)-Umfrage zu neurochirurgischen Praktiken bei der Behandlung von Shunt-Infektionen aus dem Jahr 2020 sollte hier ebenfalls erwähnt werden: Diese Umfrage zeigte ein signifikant geringeres Risiko für Shunt-Infektionen in Krankenhäusern mit besonders hohen pädiatrischen Fallzahlen [22]. Der Hintergrund hierfür ist bisher nicht verstanden. Möglich wäre aber, dass die weiter oben angeführte höhere klinische Erfahrung in solchen Krankenhäusern eine ausschlaggebende Rolle spielt.
Infektionsraten heute
Seit den 2020er Jahren wird von mehreren Autor*innen eine Spanne zwischen 5% und 17% für mögliche Infektionsraten angegeben [5; 9; 23].
In der umfangreichen prospektiven BASICS-Studie [5] (siehe Kapitel 3), wurde bei 536 Patient*innen unterschiedlichen Alters und unterschiedlicher Ätiologie eine mittlere Infektionsrate von 6% festgestellt, wobei Standard-Katheter verwendet wurden, allerdings nur für primäre Shunts. In dieser Studie wurden zusätzlich ergriffene, spezielle Maßnahmen zur Infektionsvorbeugung nach dem Zufallsprinzip verteilt (da dies ausschließlich in der Verantwortung des/der Chirurg*in lag), so dass die angegebenen 6% tatsächlich einen "Mittelwert" für primäre Shunts über alle Altersgruppen darstellen.
In der bereits erwähnten weltweiten ISPN-Umfrage 2020 berichten Behbahani et al., dass 64% der Befragten eine Infektionsrate von weniger als 5% aufweisen, während 22% der Befragten Infektionsraten von 5-10% in der pädiatrischen Patient*innen-Gruppe erwähnen [22].
In Übereinstimmung damit wurden auch in der Studie von Chu et al. [24] auf der Grundlage von 4.913 Eingriffen in 13 HCRN-Zentren des "Hydrocephalus Clinical Research Network" (HCRN) durchschnittliche Infektionsraten für Kinder von 5,1% gefunden, mit einer Varianz von 2,2% bis 9,3% pro Zentrum. Und schließlich berichten Shibamura-Fujiogi et al. auf der Grundlage von 558 Eingriffen ähnliche Werte, nämlich 4,3%. [25].
Dieser allgemeine Rückgang der Infektionsraten - im Vergleich zu früheren Zahlen - zeigt, dass die Sensibilisierung für Risikofaktoren und die Umsetzung von Maßnahmen zu ihrer Verringerung bereits erfolgreich waren. Gleichzeitig zeigt die große Varianz zwischen den Zentren, dass ein standardisierter, evidenzbasierter Ansatz für Patient*innen und Gesundheitssysteme von Vorteil sein könnte.
Wie eine Shunt-Infektion entsteht
Um Shunt-Infektionen gezielt bekämpfen zu können, ist ein Verständnis der Ursachen und des Verlaufs unabdingbar. Wegen der Dominanz der Frühinfektionen innerhalb der ersten 4 Wochen scheint es offensichtlich, dass zumindest diese Infektions-Art intraoperativ verursacht wird [16; 26]. Diese Annahme wird weiter gestützt durch die Art der überwiegend gefundenen Keime bei Frühinfektionen, bei denen es sich häufig um auf der Haut vorkommende Bakterien handelt. Diese Bakterien finden sich in der normalen Hautflora, wie z. B. koagulasenegative Staphylokokken (CoNS), z. B. Staphylococcus epidermidis und Staphylococcus aureus [4; 14; 26]. CoNS sind für 50% und Staphylococcus aureus für 33% aller Shunt-Infektionen verantwortlich [26].

Die umfangreichen Daten der BASICS-Studie wurden auch hinsichtlich der verursachenden Keime analysiert, was zu ähnlichen Ergebnissen wie denen von Wells et al. führte. Zusätzlich wurden die in dieser Auswertung gefundenen Erreger anhand der Gram-Färbung klassifiziert, da diese für die Auswahl möglicher Antibiotika entscheidend ist [5; 6] (siehe auch die "Nerdbox"):
- grampositive Bakterien machen etwa
73% aller Shunt-Infektionen aus - gramnegative Bakterien machen
etwa 20% aller Shunt-Infektionen aus - Infektionen mit gemischten grampositiven
und gramnegativen Bakterien machen
etwa 7% der gesamten Shunt-Infektionen aus
Die Kontamination des Implantats erfolgt entweder durch direkten Kontakt mit der Haut der Patient*innen oder einer der anwesenden Personen. Nach der Besetzung des Implantats haften die Erreger schnell an der Oberfläche des Biomaterials und entwickeln Strategien, um sowohl dem Immunsystem als auch einer möglichen antibiotischen Behandlung zu entgehen [27]. Hautbegleitkeime wie Staphylokokken heften sich an die Silikonoberfläche des Shuntkatheters, wo sie sich zu vermehren beginnen. Aufgrund des lebensfeindlichen Milieus im Liquor, mit niedrigem Eisengehalt und unzureichenden Kohlenstoff- und Stickstoffquellen, erfolgt diese Vermehrung langsam, aber stetig [14]. Grampositive Bakterien wie CoNS und Staphylococcus aureus treten in der Regel in Clustern auf und neigen zur Bildung sogenannter Biofilme, mit denen sie sich effektiv an Implantatmaterialien anheften können. Interessanterweise betraf der erste Bericht über einen solchen Biofilm im Jahr 1972 eine Shunt-Infektion [28].
Die Entwicklung eines Biofilms schützt das weitere Wachstum der Bakterien und erschwert die antibiotische Behandlung erheblich. Im Allgemeinen sind Biofilme Gruppen von Mikroorganismen, die an biotischen oder abiotischen Oberflächen haften und von einer Matrix umgeben sind, die aus einer extrazellulären polymeren Substanz (EPS) besteht, die extrazelluläre DNA, Proteine und Polysaccharide enthält. Diese Biofilme wirken als physische Barrieren gegen die Immunantwort des Körpers und ebenso gegen Medikamente [29]. Wenn sich die Bakterien an der Katheteroberfläche festsetzen und einen Biofilm entwickeln, ändern sie zudem ihren Stoffwechsel, um Energie zu sparen. Dieser Zustand wird als "Ruhezustand" bezeichnet und reduziert die Zahl vieler metabolischer Angriffspunkte für gängige Antibiotika, wodurch diese weniger wirksam sind [30; 31]. Wegen der verringerten Durchlässigkeit des Biofilms und der bakteriellen Ruhephase sind viel höhere - oft inakzeptabel hohe - Konzentrationen von Antibiotika erforderlich, um die Bakterien wirksam zu bekämpfen [14].
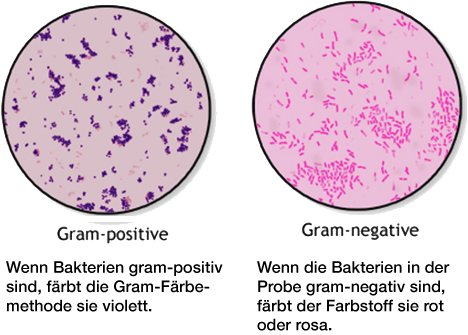
grampositive und gramnegative Bakterien
Infektionen können durch verschiedene Erreger wie Pilze, Parasiten, Algen, Viren, Prionen oder Bakterien verursacht werden. Die Bakterien können weiter nach ihrer Form unterteilt werden: kugelförmig (Kokken), stäbchenförmig (Bazillen), spiralförmig (Spirillen), kommaförmig (Vibrios) oder korkenzieherförmig (Spirochaeten). Sie können als einzelne Zellen, in Paaren, Ketten oder Clustern vorkommen.
Eine weitere Differenzierungsmethode ist die so genannte Gram-Färbemethode, benannt nach dem dänischen Bakteriologen Hans Christian Gram. Sie ist eine der wichtigsten Färbetechniken in der Mikrobiologie und in der Regel der erste Test, der zur Identifizierung von Bakterien durchgeführt wird. Die Gram-Färbung unterscheidet Bakterien anhand der chemischen und physikalischen Eigenschaften ihrer Zellwände in Gramnegativ und Grampositiv. Die Methode besteht aus einer Reihe von Färbe- und Entfärbungsschritten. Gramnegative Zellen färben sich rot bis rosa, Grampositive Zellen färben sich blau bis violett.
(https://www.cdc.gov/labtraining/docs/job_aids/routine_microscopy_procedures/Gram-Stain_508.pdf)
Der Unterschied in der Gram-Färbbarkeit ist auf die unterschiedliche Struktur der Zellwände der Bakterien zurückzuführen. Die Gram-Färbung ist wichtig für die Diagnose und vor allem Behandlung von Infektionskrankheiten. Grampositive und Gramnegative Bakterien können oft nur mit unterschiedlichen Antibiotika bekämpft werden.

Wie behandelt man Shunt-Infektionen?
Ist die Infektion erst einmal ausgebrochen, stößt man bei der Behandlung auf zahlreiche Schwierigkeiten: Viele intravenös verabreichte Antibiotika erreichen keine für eine wirksame Bekämpfung der Bakterien ausreichende Konzentration im Liquor. Zudem sind die Erreger durch ihren Ruhezustand im Biofilm geschützt [14]. Eine intravenöse oder orale Antibiotikabehandlung allein ist daher meist nicht ausreichend. Nur wenige, bestimmte frühe Shunt-Infektionen können mit besonderen biofilmaktiven Antibiotika behandelt werden [32]. Die Behandlung der Wahl besteht daher in den meisten Fällen in der Entfernung des infizierten Shunts, einer systemischen Antibiotikabehandlung, gegebenenfalls der Anlage einer externen Drainage und der anschließenden Implantation eines neuen Shunts nach Abklingen der Infektion [4; 14; 33].
Für die Patient*innen bedeutet diese Behandlung mindestens zwei zusätzliche Operationen, einen verlängerten Krankenhausaufenthalt, sowie eine belastende, langwierige Antibiose. Jede Infektion ist eine schwere Belastung für Patient*innen. Vor allem bei Kindern sind solche Infektionsepisoden auch häufig mit einer Beeinträchtigung der kognitiven Funktion und damit einhergehenden schlechteren schulischen Leistungen verbunden [16]. Wiederholte Operationen und verlängerte Krankenhausaufenthalte führen darüber hinaus auch zu deutlich höheren Kosten für das Gesundheitssystem [5; 6; 34]. Daher ist es von zentraler Bedeutung, Infektionen von vornherein zu verhindern und geeignete prophylaktische Maßnahmen zu ergreifen.
Prävention ist besser als Behandlung
Eine wirksame Prophylaxe kann nur darin bestehen, bereits vorhandene Keime schon vor der OP unschädlich zu machen und die Übertragung weiterer neuer Keime während der OP soweit wie möglich zu unterbinden. Konkret werden in der Praxis folgende Maßnahmen angewendet:
a) Verhinderung oder Verringerung des Eindringens von Keimen durch Einführung und konsequente Einhaltung strenger Hygieneprotokolle vor, während und nach der Operation
b) lokale (auch großflächige) Anwendung von antiseptischen Desinfektionsmitteln wie Povidon-Jod oder Chlorhexidin
c) prophylaktische systemische und/oder lokale Verabreichung von Antibiotika vor, während und nach der Operation
Es ist wichtig zu betonen, dass diese Maßnahmen sich nicht gegenseitig ausschließen, sondern ergänzen. Viele Studien schlagen die Kombination organisatorischer UND hygienischer Maßnahmen vor, um Infektionsrisiken zu vermeiden [13; 15; 17; 36; 37; 38]. Erwähnt werden hier Schwerpunkte in Patient*innen- und Personalvorbereitung, OP-Management, spezielle Operationstechniken sowie den zusätzlichen lokalen und systemischen Einsatz von Desinfektionsmitteln und Antibiotika. In der Regel werden diese Maßnahmen in "Protokollen" zusammengefasst, von denen einige im folgenden Abschnitt erläutert werden.
Maßnahmen eines möglichen Hygiene-Protokolls
Eines der ersten veröffentlichten Protokolle dieser Art ist das von Choux et al. von 1992 [17]. Ihr Protokoll enthielt folgende Elemente:
- Terminierung am frühen Morgen - vor anderen Operationen
- Operation von Neugeborenen und Säuglingen vor älteren Kindern
- Begrenzung der Shunt-Eingriffe pro Tag
- begrenzte Operationszeit (20 bis 40 Minuten)
- wenig Verkehr und Personal im Operationssaal
- eine*n erfahrenen Neurochirurg*in, die/der die Operation durchführt
- Öffnen der Sterilverpackung im letzten Moment
- Shunt-Materialien, die vor den Hautinzisionen mit Antibiotika und intravenösen Antibiotika gespült werden
Nach Einführung des Protokolls zwischen 1983 und 1990 konnte die Inzidenz von Shunt-Infektionen von ca. 15% auf 0,33% pro Patient*in und von ca. 8% auf 0,17% pro Eingriff drastisch reduziert werden [17].
Später wurde dieses Protokoll von verschiedenen neurochirurgischen Abteilungen angepasst, so dass bis heute eine Vielzahl von Einzelmaßnahmen getestet wurde. Für pädiatrische Patient*innen sind die vom "Hydrocephalus Clinical Research Network" (HCRN) in den USA veröffentlichten detaillierten Protokolle ein bemerkenswertes Beispiel. Das HCRN ist ein großer Zusammenschluss pädiatrischer neurochirurgischer Zentren, die systematische Untersuchungen zur Behandlung des pädiatrischen Hydrocephalus durchführen. Auf der Grundlage einer ihrer Erkenntnisse, nämlich dass das Fehlen einer ordnungsgemäßen Technik des Händewaschens durch das gesamte Operationsteam ein wichtiger Risikofaktor für Infektionen ist, haben sie eine formelle chirurgische Handdesinfektion mit Povidon-Jod oder Chlorhexidin-Putzbürsten und nicht nur die Verwendung einer antiseptischen Creme eingeführt [37]. Mit der Einführung dieses Protokolls, das 2011 veröffentlicht wurde, konnte die Infektionsrate von 8,8% vor dem Protokoll auf 5,7% gesenkt werden.
Okamura et al. [23] veröffentlichten im Jahr 2020 ein Protokoll für eine ältere Patient*innen-Gruppe, mit dem sie die Infektionen durch Shunts von 7,3% auf 0% senken konnten. Das Durchschnittsalter der Patienten vor und nach der Einführung des Protokolls betrug etwa 59 Jahre. Ihr Protokoll umfasst:
- Priorisierung von Shunt-Operationen als erster Eingriff pro Tag in jedem Operationssaal
- Minimierung der Türöffnungen und der Anzahl der Mitarbeiter*innen im OP
- doppelte Handschuhe mit Wechsel der Außenhandschuhe unmittelbar vor dem Hautschnitt
- Öffnen der Sterilverpackung mit dem Implantat kurz vor dem Hautschnitt und Eintauchen in Vancomycinlösung
- Injektion von Vancomycin und Gentamycin in das Reservoir nach der Implantation
- postoperatives Management der Sauerstoffzufuhr und strenge Kontrolle des Blutzuckerspiegels
- postoperativer, intravenöser Antibiotika-Tropf
- Verbandswechsel mindestens einmal innerhalb von 24 Stunden
Die vorgestellten Protokolle zeigen sehr schön, dass es viele Überschneidungen zwischen den Maßnahmen gibt, die verschiedene Zentren zur Reduzierung von Shunt-Infektionen ergreifen. Insgesamt gibt es sehr viele mögliche Einzelmaßnahmen, deren Bewertung sich aber im Laufe der Zeit zum Teil gewandelt hat.
So hat Faillache bereits 1995 das "No-Touch-Protokoll" entwickelt und dessen Wirksamkeit zumindest in seiner eigenen Studie nachgewiesen. Bei dieser Methode werden die Implantate so weit wie möglich nur mit sterilen Instrumenten berührt und implantiert [13; 15; 37; 39].
Heute wird die präoperative Rasur der Haare über der Inzisionsstelle, die auch im "No-Touch-Protokoll" erwähnt wird, nicht mehr als notwendig bzw. wirksam erachtet [14]. Stattdessen können sich Kliniken oder Chirurg*innen für eine „No-Shave“-Politik entscheiden. In einigen Protokollen wird dies mit einer präoperativen Chlorhexidin-Haarwäsche und einer Dusche oder einem Bad kombiniert [13; 15; 37].
Umgekehrt wird die Praxis des "double-gloving" (doppelte Handschuhe), die auch schon von Faillace dokumentiert wurde [39], heute allgemein als gute Maßnahme zur Minimierung des Kontaminationsrisikos anerkannt. Handschuhe können schon früh während der Operation durch Hautkontakt kontaminiert werden. "Doppelte Handschuhe" bedeutet, dass das äußere Paar vor Berührung der Ventile entfernt oder gewechselt werden kann [15; 37; 40; 41].
In einigen anderen Protokollen wurden auch antimikrobielles Nahtmaterial und Abdeckungen getestet [15; 37; 42]. In einer kleinen, randomisierten, kontrollierten Studie untersuchten Rozelle et al. die Wirkung von mit Triclosan beschichtetem Nahtmaterial. Die Verwendung dieses Nahtmaterials führte zu einem Rückgang der Infektionen von 21% in der Kontrollgruppe auf 4,3% in der Gruppe mit Triclosan-beschichtetem Nahtmaterial, was darauf hindeutet, dass einige Infektionen auf postoperative Wundvereiterungen zurückzuführen sind [14; 42]. Mit Jod imprägnierte Inzisionsabdeckungen können nützlich sein, um die Stofftücher abzudecken und eine trockene aseptische Oberfläche zu schaffen [13; 15; 43].
Natürlich kann jede einzelne Maßnahme in einem Protokoll nur dann eine prophylaktische Wirkung haben, wenn sie strikt eingehalten wird und wenn Abweichungen erkannt und behoben werden. Unter anderem wiesen Hommelstad und Bayston auf die entscheidende Bedeutung der Einhaltung des Protokolls für ihren Erfolg hin [13; 14]. Insbesondere wenn viele verschiedene Personen an der Operation teilnehmen, wie z. B. Student*innen in akademischen Lehrkrankenhäusern, könnte die Anwesenheit eines/einer erfahrenen Neurochirurg*in hilfreich sein und sich nicht nur auf die Dauer der Operation, sondern auch auf das Verhalten aller Beteiligten, d.h. auf die strikte Einhaltung des Protokolls auswirken.
Systemische vs. lokale/topische prophylaktische Antibiose
Die bisher diskutierten Protokolle haben auch gezeigt, dass der perioperative Einsatz von intravenös verabreichten Antibiotika ("systemische Antibiose") eine häufig angewandte Maßnahme ist. Dies erscheint jedoch fragwürdig, insbesondere im Hinblick auf das rechtzeitige Eindringen von intravenösen Antibiotika in den Liquor. Trotz einer solchen Antibiotikaprophylaxe berichteten mehrere Zentren über Infektionsraten, die als unannehmbar hoch angesehen werden [12; 14; 15; 44]. Die Verwendung einer prophylaktischen Antibiose steht im Zusammenhang mit der Frage nach den Vor- und Nachteilen einer systemischen oder lokalen Antibiotikaprophylaxe, die häufig zur Bekämpfung chirurgischer Implantatinfektionen kombiniert werden.
Wie bereits erwähnt, sind aufgrund der metabolischen Veränderungen der Bakterien im Biofilm sehr hohe Antibiotikakonzentrationen erforderlich, um diese zu neutralisieren. Außerdem ist die Liquor-Penetration einiger Antibiotika begrenzt [14; 32]. Bei der systemischen Anwendung werden daher oft keine ausreichend hohen Konzentrationen im Liquor erreicht, so dass sie weder bei der Behandlung noch bei der Vorbeugung von Infektionen die gewünschte Wirkung haben. Im Gegensatz dazu können bei der lokalen oder topischen Anwendung antimikrobieller Wirkstoffe höhere Wirkstoffkonzentrationen direkt auf der Oberfläche des Implantates und in dessen Umgebung erreicht werden. Sie sollen verhindern, dass sich Organismen überhaupt auf dem Implantat ansiedeln und das Gewebe um das Implantat herum schützen [1].
Evidenz für die Infektionsvorbeugenden Protokoll-Elemente
Wie im Vorangehenden dargestellt, gibt es viele verschiedene prophylaktische Maßnahmen, von denen die meisten sofort plausibel erscheinen und auch in der Praxis angewendet werden. Der "Grad der klinischen Evidenz " für die verschiedenen Maßnahmen ist jedoch unterschiedlich, wobei die meisten von ihnen keinen hohen Evidenzgrad aufweisen. Damit ist der verlässliche klinische Nachweis gemeint, ob die Maßnahme überhaupt wirksam ist oder nicht. Aufgrund der heutigen niedrigen Infektionsraten ist die Untersuchung der Bedeutung und der Wirksamkeit jedes einzelnen Elements des Protokolls eine Herausforderung: Es wären große Patient*innen-Kohorten erforderlich, und jede Maßnahme dieser Protokolle müsste "isoliert" in randomisierten kontrollierten Studien (RCTs) untersucht werden, um ihre Auswirkungen auf den Rückgang der Infektionsraten angemessen zu bewerten. Schon aus ethischen Gründen ist eine Studie, die im Extremfall nur eine einzige prophylaktische Maßnahme vorsieht und andere bekannte Maßnahmen auslässt, kritisch zu bewerten. Allerdings hält Bayston [14] diesen scheinbaren Mangel an Evidenz für akzeptabel, wenn man bedenkt, dass die Infektionsraten nach Einführung eines bestimmten Protokolls in der Regel zurückgehen.
Eine der Ausnahmen von diesem „Mangel an Evidenz“ ist die Wirksamkeit des Einsatzes von antibiotisch-imprägnierten Kathetern (AICs), die kürzlich durch die BASICS-Studie nachgewiesen wurde [5; 6]. Dementsprechend wird auch die Verwendung von AICs derzeit in den klinischen Praxisleitlinien der IDSA ("Infectious Diseases Society of America") von 2017 [7] und den Hydrocephalus-Leitlinien für pädiatrische Patient*innen ("Pediatric hydrocephalus: systematic literature review and evidence-based guidelines" [45]) empfohlen. Das letztere Dokument, das im Jahr 2020 aktualisiert wurde, enthält sogar die höchste "Level 1-Empfehlung" für die Anwendung von AICs [46].
Die Wirkungsweise solcher AICs und die vorliegende Evidenz für ihren Nutzen werden im folgenden Kapitel beschrieben.

Bei antibiotisch-imprägnierte Kathetern (AIC) wirken die Antibiotika im Bereich der kritischen Operationswunden und direkt an der Oberfläche des Implantats. Es handelt sich also um eine lokale Anwendung von Antibiotika, bei der über die Katheter für eine bestimmte Zeit lang Antibiotika an das umliegende Gewebe abgeben werden. Anstelle einer antimikrobiellen Beschichtung der Oberfläche, wie es manchmal bei anderen Implantaten der Fall ist, bedeutet "Imprägnierung", dass die Antibiotika in die Silikonmatrix des Katheters eingebettet sind. Bei der Herstellung solcher "imprägnierter" Katheter wird die Tatsache ausgenutzt, dass bestimmte organische Lösungsmittel vom Silikon aufgesogen werden, wie Wasser von einem Schwamm. Beim Trocknen, d.h. wenn das Lösungsmittel wieder aus dem Silikon entweicht, bleiben die gelösten Antibiotika im Katheter. Von dort werden sie mindestens in den kritischen ersten vier Wochen nach der Implantation langsam in den Liquor und das umliegende Gewebe abgegeben. Diese Antibiotika-Abgabezeit kann durch die entsprechende Produktion festgelegt werden. Im Vergleich zu einer einmaligen Gabe von Antibiotika während der Operation ist die Abgabe über diesen kritischen Zeitraum natürlich ein entscheidender Vorteil. Ein weiterer Vorteil ist, dass das Antibiotikum nicht nur von außen auf das umgebende Gewebe wirkt, sondern auch in dem mit Liquor gefüllten inneren Katheterlumen.
Das Prinzip für einen solchen imprägnierten Katheter wurde bereits 1987 von Roger Bayston und Nancy Grove patentiert und beschrieben (US-Patent Nr. 4,917,686, siehe https://patents.google.com/patent/US4917686A/en) [47; 48]. Als erster kommerzieller AIC, der mit Rifampicin (0,054 m%) in Kombination mit Clindamycin-Hydrochlorid (0,15 m%) imprägniert war, kam "Bactiseal" von Codman auf den Markt, der von Alfred Aschoff bereits 1999 erwähnt wurde [49]. Es gibt also bereits mehr als 20 Jahren klinische Erfahrung mit Kathetern solcher Art.
Die Auswahl und Konzentration der Antibiotika, die zur Katheter-Imprägnierung verwendet werden, müssen verschiedene Randbedingungen erfüllen. Die Antibiotika müssen nicht nur gegen die wichtigsten grampositiven Erreger wirksam (wie in Abbildung 2 dargestellt), sondern auch mit der Silikonmatrix kompatibel sein. Nur dann kann die Freisetzungsrate im implantierten Zustand genau eingestellt werden. Rifampicin ist in dieser Hinsicht ideal geeignet.
Bereits im Jahr 2000 haben Kockro, Aschoff et al. [50] eine sehr eindrucksvolle vergleichende Studie unter dem Elektronenmikroskop (Rasterelektronenmikroskopie, REM) durchgeführt, in der der schnelle zeitliche Verlauf der bakteriellen Besiedlung und Biofilmbildung auf einem einfachen und einem mit Rifampicin imprägnierten Katheter direkt zu sehen ist. Abbildung 3 zeigt, wie das Wachstum von Keimen auf dem AIC fast vollständig unterdrückt wird.

Rifampicin ist jedoch leider auch für seine schnelle Resistenzentwicklung bekannt [51]. Daher wurde es mit einem zweiten Antibiotikum (Clindamycin-Hydrochlorid) kombiniert, das eine andere Wirkungsweise hat und somit die Entwicklung von Resistenzen unwahrscheinlicher macht. Ein weiterer Vorteil der Kombination von zwei verschiedenen Antibiotika ist, dass die individuellen Konzentrationen niedriger sein und somit lokal toxische Konzentrationen vermieden werden können [52]
Seit der ersten klinischen Studie im Jahr 2003 wurde Bactiseal sehr häufig verwendet und beschrieben [53; 54]. Im Jahr 2011 brachte Medtronic zusätzlich den ARES-Katheter auf den Markt, der den gleichen Spezifikationen hinsichtlich der Art und Menge der verwendeten antimikrobiellen Wirkstoffe entspricht (510(k)-Nr.:K110560). Es liegen zahlreiche Studiendaten über den Einsatz dieser Produkte vor, die die Sicherheit und Wirksamkeit solcher AICs im Bereich der Hydrocephalus-Therapie belegen. In den westlichen Ländern werden AICs heute in einer deutlichen Mehrheit der Fälle als Teil der prophylaktischen Protokolle eingesetzt. In ihrer weltweiten Umfrage analysierten Behbabani at el. 118 vollständige Antworten. Die Auswertung ergab, dass AICs in etwa 80% der amerikanischen und europäischen Einrichtungen verfügbar sind. Viele andere neurochirurgische Zentren gaben an, dass sie routinemäßig AIC für alle Shunt- oder EVD-Verfahren verwenden [25; 55; 56]. Daten aus zwei großen multizentrischen Studien weisen ebenfalls auf den weit verbreiteten Einsatz von AICs bei pädiatrischen Patient*innen in den USA hin: Die gemeldeten Einsatzraten lagen bei über 50% in der Studie von Lakomkin et al. [57] (2007 Fälle) und über 80% bei Chu et al. [24] (4913 Fälle).
Klinische Evidenz für AICs: Die BASICS-Studie
Wie bereits erwähnt, fehlt für viele einzelne prophylaktische Maßnahmen in den beschriebenen Protokollen streng gefasst die klinische Evidenz, mit Ausnahme der AICs. Denn im Jahr 2019 wurde die Wirksamkeit von AICs zum ersten Mal und mit einem sehr hohen Evidenzgrad in der BASICS-Studie nachgewiesen [5; 6]. Bei der BASICS-Studie handelt es sich um eine randomisierte, prospektive, kontrollierte Studie (RCTs) mit hervorragendem Studiendesign und valider Fallzahlplanung. Es ist zunächst überraschend, dass dieser Nachweis erst so spät, d.h. erst vor kurzem erbracht wurde, da Katheter dieser Art bereits seit über zwei Jahrzehnten auf dem Markt sind und eine Vielzahl von Studien zu ihrem Einsatz vorliegen. Diese Tatsache unterstreicht, wie zeitaufwändig, kostenintensiv und schwierig es ist, eine ordentliche, gut konzipierte RCT durchzuführen. Alle bisherigen Studien, einschließlich der prospektiven randomisierten Studien, hatten zu geringe Fallzahlen, um die AIC-Wirksamkeit mit großer Evidenz zu belegen.
Die BASICS-Studie hingegen muss als eine herausragende, erstklassige RCT angesehen werden, die in Bezug auf Design, Durchführung und Auswertung durchdacht und angemessen ist. Insbesondere die im Vergleich zu anderen Studien sehr hohe endgültige Fallzahl von 1.605 Patient*innen entspricht einer ausreichenden Studienpower von mindestens 80%. Sie vergleicht drei Behandlungsgruppen miteinander, weshalb sie auch als 3-armige Studie bezeichnet wird: Standardkatheter, silberimprägnierte Katheter und AICs. Silberimprägnierte Katheter (SICs) haben theoretisch einen ähnlichen Wirkmechanismus wie AICs, nutzen aber Silber als antimikrobiellen Wirkstoff. Wie bei den AICs befindet sich das Silber in der Silikonmatrix und soll im implantierten Zustand durch Lösung an die Umgebung abgegeben werden. SICs werden in der Literatur deutlich seltener als AICs beschrieben und ihre Wirksamkeit ist umstritten.
Insgesamt wurden 1.605 Patient*innen aller Altersgruppen und Hydrocephalus-Ätiologien in 21 britischen und irischen Krankenhäusern zwischen 2013 und 2017 untersucht, d. h. mehr als 530 Fälle pro Gruppe. Es wurden nur Patient*innen eingeschlossen, die zum ersten Mal einen ventrikuloperitonealen Shunt (von einem beliebigen Hersteller) erhielten. Patient*innen mit Folge-Shunts wurden ausgeschlossen, da diese bekanntermaßen ein erhöhtes Infektionsrisiko aufweisen und daher nicht fair mit Erst-Shunts verglichen werden können. Nach der Implantation wurden alle Patient*innen für mindestens 6 Monate und maximal 2 Jahre nachbeobachtet.
Als Ergebnis wurde ein signifikanter Unterschied zwischen der Infektionsrate von 6% in der Standardgruppe und 2% in der AIC-Gruppe festgestellt. Die leicht zu übersehende, aber wichtige Aussage, dass diese Verringerung "signifikant" war, bedeutet, dass dieser Unterschied mit ziemlicher Sicherheit nicht auf Zufall - "aufgrund normaler, unvermeidbarer Variabilität" - sondern tatsächlich auf die Wirksamkeit der AICs zurückzuführen ist. Als wichtiges Ergebnis der BASICS-Studie soll hier betont werden, dass die Gruppe mit den Silberkathetern die gleiche Infektionsrate wie die Standardgruppe (6%) aufwies, so dass nicht von einer Wirksamkeit der SICs ausgegangen werden kann.
Die umfangreichen BASICS-Daten wurden auch im Hinblick auf die entstehenden Kosten gründlich analysiert. Das Ergebnis ist, dass der Einsatz von AICs zu einer effektiven Kosteneinsparung (im britischen Gesundheitssystem) von £135.753 (ca. $171.000, ca. €158.000) pro vermiedene Infektion führt. Diese Zahl stimmt gut mit den Ergebnissen früherer umfassender Kosten-Nutzen-Analysen überein. Im Jahr 2015 analysierten Parker et al. Daten aus 287 US-Krankenhäusern von 10.819 erwachsenen und 1.770 pädiatrischen Patient*innen [59]. Sie schätzen die gesamten zusätzlichen Kosten pro Infektion auf ca. 45.000 - 95.000$ für Erwachsene und ca. 56.000 - 121.000$ für Kinder.
„In analysis of this large, nationwide database, AICs were found to be associated with a significant reduction in infection incidence, resulting in tremendous cost savings. AICs were associated with a cost savings of $42.125 and $230.390 per 100 de novo shunts placed in adult and pediatric patients, respectively.“
["Bei der Analyse dieser großen, landesweiten Datenbank wurde festgestellt, dass AICs mit einer signifikanten Verringerung der Infektionsinzidenz einhergehen, was zu enormen Kosteneinsparungen führt. AICs waren mit einer Kostenersparnis von 42,125 $ und 230,390 $ pro 100 neu angelegte Shunts bei erwachsenen bzw. pädiatrischen Patienten verbunden."]
Ebenfalls im Jahr 2015 legten Edwards et al. [34] eine umfassende Literaturanalyse vor, die zu folgendem Ergebnis kam:
“The rate of decrease in infection with AIC shunts was shown to have the greatest impact on the cost savings realized with use of AIC shunts.”
["Es hat sich gezeigt, dass der Rückgang der Infektionen mit AIC-Shunts den größten Einfluss auf die Kosteneinsparungen hat, die durch die Verwendung von AIC-Shunts erzielt werden."]
Hinsichtlich der Kosten-Nutzen-Analyse hat die BASICS-Studie somit die früheren Analysen voll bestätigt und trotz der höheren Anfangskosten kann eine relevante Kosteneinsparung durch den Einsatz von AICs nun als sicher gelten.
Die Abnahme der Infektionswahrscheinlichkeit mit dem Alter wurde ebenfalls bestätigt, wobei die Wirksamkeit der AICs bei Kindern und Personen mit hohen Infektionsraten am deutlichsten ist.
BASICS kam jedoch auch zu einem unerwarteten Ergebnis: Die kumulativen Gesamtrevisionsraten, die alle möglichen Komplikationen oder Shuntausfälle einschließen, blieben für AICs genauso hoch wie für Standardkatheter (und Silberkatheter). Mit anderen Worten: Die mittlere Lebensdauer des Shunts hat sich mit AICs trotz eines geringeren Infektionsrisikos nicht erhöht. In der AIC-Studiengruppe traten anstelle von Infektionen häufiger andere Komplikationen auf, so dass die relative Zahl aller Revisionen unverändert blieb. Vor allem Verstopfungen des Ventrikelkatheters und der Ventile nahmen zu. Mallucci et al. stellten die Hypothese auf, dass die AICs eine Infektion in eine niedriggradige Infektion umwandeln, bei der sich die ursprünglichen Erreger mit geringer Virulenz auf einen Biofilm im (nicht imprägnierten) Ventilkörper beschränken. Dies könnte dann zu einem mechanischen Versagen führen. Die Autoren schreiben:
“However, changes in CSF composition and flow (such as debris or high protein) might block the intricate valve mechanism. Our study was not powered or designed to answer this question directly, [...] Nevertheless, from the patient’s perspective, although mechanical shunt revision still requires surgery which could impact on quality of life, the hospital admission is short, prolonged antibiotics are not required, and patients recover faster with fewer long-term neurological sequelae than if their shunts become infected.”
["Veränderungen in der Liquor-Zusammensetzung und im Liquor-Fluss (z. B. Trümmer oder ein hoher Eiweißgehalt) könnten jedoch den komplizierten Ventilmechanismus blockieren. Unsere Studie war nicht darauf ausgerichtet, diese Frage direkt zu beantworten, [...] Aus Sicht der Patient*innen ist die Revision eines mechanischen Shunts zwar immer noch ein chirurgischer Eingriff, der die Lebensqualität beeinträchtigen kann, aber der Krankenhausaufenthalt ist kurz, eine längere Antibiotikaeinnahme ist nicht erforderlich, und die Patient*innen erholen sich schneller und haben weniger neurologische Langzeitfolgen als bei einer Infektion des Shunts."]
Eine Revision aufgrund einer Infektion ist eindeutig eine schlimmere Komplikation als eine Revision aus anderen Gründen, da diese Infektionen schwieriger zu behandeln sind und das Risiko von Folgeinfektionen erhöhen. Langwierige Antibiotikabehandlungen und Re-Operationen sind nicht nur für Patient*innen verheerend, sondern stellen auch eine große Belastung für das Gesundheitssystem dar, da mehr Kosten für die Behandlung (Antibiotika, mehrfache Operationen) und die verlängerten Krankenhausaufenthalte anfallen.
Sollte sich das Auftreten erhöhter Revisionsraten aus nicht-infektiösen Gründen beim Einsatz von AICs tatsächlich bestätigen, so muss in Zukunft die dahinterliegende Ursache geklärt werden.
Wir schließen unseren Überblick mit einem Zitat aus einer anderen aktuellen Meta-Analyse, die sich kritisch mit den Ergebnissen der BASICS-Studie auseinandersetzt, der Studie von Goda et al. [60]. Diese Arbeit soll hier nicht unerwähnt bleiben, weil sie verschiedene, eher selten verwendete, komplexe Methoden ("Cochrane risk of bias assessment tool", "trial sequential analysis", "network meta-analysis") zur Klärung der Evidenzfrage anwendet:
“…antibiotic medicated ventriculoperitoneal shunts had the highest probability of being the best option in terms of the relative infection rates.”
["... Antibiotika-haltige ventrikuloperitoneale Shunts hatten die höchste Wahrscheinlichkeit, die beste Option im Hinblick auf die relativen Infektionsraten zu sein."]
Die bisher vorliegenden Erkenntnisse weisen somit auf die Wirksamkeit und Kosteneffizienz von antibiotisch imprägnierten Kathetern hin, die den Chirurg*innen eine gut untersuchte Option zur Eindämmung von Infektionsrisiken bei Shuntoperationen bieten.

Shunt-Infektionen sind eine häufige und schwerwiegende Komplikation bei der Shunt-Behandlung. Sie beeinträchtigen die Lebensqualität der Patient*innen massiv und führen zu erheblichen Kosten für das Gesundheitssystem. Die meisten Infektionen treten im ersten Monat nach der Operation auf, was darauf schließen lässt, dass die Kontamination des Implantats höchstwahrscheinlich während der Operation erfolgt. Chirurgische Implantatinfektionen sind oft schwer zu behandeln, da die beteiligten Bakterien häufig in der Lage sind, Biofilme zu bilden, die sie wirksam vor Immunreaktionen des Wirts und medikamentösen Behandlungen schützen. Infizierte Shunts müssen daher entfernt und die Patient*innen mit Antibiotika behandelt werden, bevor ein neuer Shunt implantiert werden kann.
Die Vorbeugung von Infektionen und deren schwierige und belastende Behandlung durch prophylaktische Hygienemaßnahmen ist daher von größter Bedeutung.
Eine Fülle von Daten zeigt, dass es prophylaktische Maßnahmen gibt, mit denen sich Shunt-Infektionen erfolgreich reduzieren lassen. Die besten Ergebnisse wurden mit einem Bündel verschiedener Maßnahmen erzielt, darunter bekannte, vernünftige, aseptische Techniken wie die präoperative Vorbereitung der Patient*innen, die Planung und das Timing von Shunt-Operationen, intraoperative Maßnahmen wie das doppelte Anlegen von Handschuhen und "No-touch"-Methoden sowie die Antibiotikaprophylaxe. Als lokale Anwendung von Antibiotika haben sich antibiotisch-imprägnierte Katheter (AIC) schnell zu einer weit verbreiteten Präventionsmaßnahme entwickelt. Klinische Studien haben gezeigt, dass die Zahl der Shunt-Infektionen im Vergleich zu anderen Kathetern abnimmt und dass sie kosteneffizient sind. AIC sind besonders vorteilhaft für Patient*innen mit einem höheren Infektionsrisiko, d. h. Kinder, (Früh-)Neugeborene, Patient*innen mit wiederkehrenden Infektionen, geschwächten Immunsystem oder chronischen Erkrankungen, sowie Patient*innen, die zuvor mit EVD behandelt wurden.
Heutzutage kann die Verwendung von AICs als Stand der Technik angesehen werden und wird dementsprechend in mehreren Leitlinien empfohlen.
Literaturverzeichnis
1. Darouiche RO. Antimicrobial approaches for preventing infections associated with surgical implants. Clin Infect Dis. 2003 May 15;36(10):1284-9. doi: 10.1086/374842. Epub 2003 May 9.
2. Isaacs AM, Yang R, Cadieux M, Ben-Israel D, Sader N, Opoku-Darko M, Frizon L, Yong H, Premji Z, Nagel S, Hamilton MG; Adult Hydrocephalus Clinical Research Network (AHCRN); Other Adult Hydrocephalus Clinical Research Network Site Principal Investigators. Characteristics of shunt failure in 38,095 adult shunt insertion surgeries: a systematic review and meta-analysis. Neurosurg Focus. 2023 Apr;54(4):E2. doi: 10.3171/2023.1.FOCUS22637.
3. Hauptman, J.S., Lutz, B.R., Hanak, B.W., Browd, S.R. (2019). Technical Advances in the Treatment of Hydrocephalus: Current and Future State. In: Limbrick Jr., D., Leonard, J. (eds) Cerebrospinal Fluid Disorders . Springer, Cham. doi.org/10.1007/978-3-319-97928-1_21.
4. Borgbjerg BM, Gjerris F, Albeck MJ, Børgesen SE. Risk of infection after cerebrospinal fluid shunt: an analysis of 884 first-time shunts. Acta Neurochir (Wien). 1995;136(1-2):1-7. doi: 10.1007/BF01411427.
5. Mallucci CL, Jenkinson MD, Conroy EJ, Hartley JC, Brown M, Dalton J, Kearns T, Moitt T, Griffiths MJ, Culeddu G, Solomon T, Hughes D, Gamble C; BASICS Study collaborators. Antibiotic or silver versus standard ventriculoperitoneal shunts (BASICS): a multicentre, single-blinded, randomised trial and economic evaluation. Lancet. 2019 Oct 26;394(10208):1530-1539. doi: 10.1016/S0140-6736(19)31603-4. Epub 2019 Sep 12. Erratum in: Lancet. 2019 Sep 18;: Erratum in: Lancet. 2020 Jun 13;395(10240):1834.
6. Mallucci CL, Jenkinson MD, Conroy EJ, Hartley JC, Brown M, Moitt T, Dalton J, Kearns T, Griffiths MJ, Culeddu G, Solomon T, Hughes D, Gamble C; BASICS study collaborators. Silver-impregnated, antibiotic-impregnated or non-impregnated ventriculoperitoneal shunts to prevent shunt infection: the BASICS three-arm RCT. Health Technol Assess. 2020 Mar;24(17):1-114. doi: 10.3310/hta24170.
7. Tunkel AR, Hasbun R, Bhimraj A, Byers K, Kaplan SL, Scheld WM, van de Beek D, Bleck TP, Garton HJL, Zunt JR. 2017 Infectious Diseases Society of America's Clinical Practice Guidelines for Healthcare-Associated Ventriculitis and Meningitis. Clin Infect Dis. 2017 Mar 15;64(6):e34-e65. doi: 10.1093/cid/ciw861.
8. Bock HC, Kanzler M, Thomale UW, Ludwig HC. Implementing a digital real-time Hydrocephalus and Shunt Registry to evaluate contemporary pattern of care and surgical outcome in pediatric hydrocephalus. Childs Nerv Syst. 2018 Mar;34(3):457-464. doi: 10.1007/s00381-017-3654-0. Epub 2017 Nov 9.
9. Fernández-Méndez R, Richards HK, Seeley HM, Pickard JD, Joannides AJ; UKSR collaborators. Current epidemiology of cerebrospinal fluid shunt surgery in the UK and Ireland (2004-2013). J Neurol Neurosurg Psychiatry. 2019 Jul;90(7):747-754. doi: 10.1136/jnnp-2018-319927. Epub 2019 Mar 25.
10. Pickard JD, Richards H, Joannides A (2017) UK Shunt Registry Draft Report:2017
11. George R, Leibrock L, Epstein M. Long-term analysis of cerebrospinal fluid shunt infections. A 25-year experience. J Neurosurg. 1979 Dec;51(6):804-11. doi: 10.3171/jns.1979.51.6.0804.
12. Michelle Paff, Daniela Alexandru-Abrams, Michael Muhonen, William Loudon, Ventriculoperitoneal shunt complications: A review, Interdisciplinary Neurosurgery, Volume 13, 2018, Pages 66-70, ISSN 2214-7519, doi.org/10.1016/j.inat.2018.04.004.
13. Hommelstad J, Madsø A, Eide PK. Significant reduction of shunt infection rate in children below 1 year of age after implementation of a perioperative protocol. Acta Neurochir (Wien). 2013 Mar;155(3):523-31. doi: 10.1007/s00701-012-1574-z. Epub 2012 Dec 8.
14. Bayston, R. (2021). Infections in CSF Shunts and External Ventricular Drainage. In P. K. Bektaşoğlu & B. Gürer (Eds.), Cerebrospinal Fluid. IntechOpen. doi.org/10.5772/intechopen.98910
15. Sarmey N, Kshettry VR, Shriver MF, Habboub G, Machado AG, Weil RJ. Evidence-based interventions to reduce shunt infections: a systematic review. Childs Nerv Syst. 2015 Apr;31(4):541-9. doi: 10.1007/s00381-015-2637-2. Epub 2015 Feb 17.
16. Vinchon M, Dhellemmes P. Cerebrospinal fluid shunt infection: risk factors and long-term follow-up. Childs Nerv Syst. 2006 Jul;22(7):692-7. doi: 10.1007/s00381-005-0037-8. Epub 2006 Mar 14.
17. Choux M, Genitori L, Lang D, Lena G. Shunt implantation: reducing the incidence of shunt infection. J Neurosurg. 1992 Dec;77(6):875-80. doi: 10.3171/jns.1992.77.6.0875.
18. Cochrane DD, Kestle JR. The influence of surgical operative experience on the duration of first ventriculoperitoneal shunt function and infection. Pediatr Neurosurg. 2003 Jun;38(6):295-301. doi: 10.1159/000070413.
19. Prusseit J, Simon M, von der Brelie C, Heep A, Molitor E, Volz S, Simon A. Epidemiology, prevention and management of ventriculoperitoneal shunt infections in children. Pediatr Neurosurg. 2009;45(5):325-36. doi: 10.1159/000257520. Epub 2009 Nov 11.
20. Simon TD, Butler J, Whitlock KB, Browd SR, Holubkov R, Kestle JR, Kulkarni AV, Langley M, Limbrick DD Jr, Mayer-Hamblett N, Tamber M, Wellons JC 3rd, Whitehead WE, Riva-Cambrin J; Hydrocephalus Clinical Research Network. Risk factors for first cerebrospinal fluid shunt infection: findings from a multi-center prospective cohort study. J Pediatr. 2014 Jun;164(6):1462-8.e2. doi: 10.1016/j.jpeds.2014.02.013. Epub 2014 Mar 21.
21. Simon TD, Hall M, Riva-Cambrin J, Albert JE, Jeffries HE, Lafleur B, Dean JM, Kestle JR; Hydrocephalus Clinical Research Network. Infection rates following initial cerebrospinal fluid shunt placement across pediatric hospitals in the United States. Clinical article. J Neurosurg Pediatr. 2009 Aug;4(2):156-65. doi: 10.3171/2009.3.PEDS08215.
22. Behbahani M, Khalid SI, Lam SK, Caceres A. Global trends in the evaluation and management of cerebrospinal fluid shunt infection: a cooperative ISPN survey. Childs Nerv Syst. 2020 Dec;36(12):2949-2960. doi: 10.1007/s00381-020-04699-z. Epub 2020 Jun 9.
23. Okamura Y, Maruyama K, Fukuda S, Horikawa H, Sasaki N, Noguchi A, Nagane M, Shiokawa Y. Detailed standardized protocol to prevent cerebrospinal fluid shunt infection. J Neurosurg. 2019 Feb 15;132(3):755-759. doi: 10.3171/2018.10.JNS181432.
24. Chu J, Jensen H, Holubkov R, Krieger MD, Kulkarni AV, Riva-Cambrin J, Rozzelle CJ, Limbrick DD, Wellons JC, Browd SR, Whitehead WE, Pollack IF, Simon TD, Tamber MS, Hauptman JS, Pindrik J, Naftel RP, McDonald PJ, Hankinson TC, Jackson EM, Rocque BG, Reeder R, Drake JM, Kestle JRW; Hydrocephalus Clinical Research Network; Hydrocephalus Clinical Research Network Members. The Hydrocephalus Clinical Research Network quality improvement initiative: the role of antibiotic-impregnated catheters and vancomycin wound irrigation. J Neurosurg Pediatr. 2022 Mar 18;29(6):711-718. doi: 10.3171/2022.2.PEDS2214.
25. Shibamura-Fujiogi M, Ormsby J, Breibart M, Warf B, Priebe GP, Soriano SG, Sandora TJ, Yuki K. Risk factors for pediatric surgical site infection following neurosurgical procedures for hydrocephalus: a retrospective single-center cohort study. BMC Anesthesiol. 2021 Apr 21;21(1):124. doi: 10.1186/s12871-021-01342-5.
26. Wells DL, Allen JM. Ventriculoperitoneal shunt infections in adult patients. AACN Adv Crit Care. 2013 Jan-Mar;24(1):6-12; quiz 13-4. doi: 10.1097/NCI.0b013e31827be1d1.
27. Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 2018 Jul;16(7):397-409. doi: 10.1038/s41579-018-0019-y.
28. Bayston R, Penny SR. Excessive production of mucoid substance in staphylococcus SIIA: a possible factor in colonisation of Holter shunts. Dev Med Child Neurol Suppl. 1972;27:25-8. doi: 10.1111/j.1469-8749.1972.tb09769.x.
29. Zhang K, Li X, Yu C, Wang Y. Promising Therapeutic Strategies Against Microbial Biofilm Challenges. Front Cell Infect Microbiol. 2020 Jul 28;10:359. doi: 10.3389/fcimb.2020.00359.
30. Gilbert P, Collier PJ, Brown MR. Influence of growth rate on susceptibility to antimicrobial agents: biofilms, cell cycle, dormancy, and stringent response. Antimicrob Agents Chemother. 1990 Oct;34(10):1865-8. doi: 10.1128/AAC.34.10.1865.
31. Schierholz JM, Beuth J. Implant infections: a haven for opportunistic bacteria. J Hosp Infect. 2001 Oct;49(2):87-93. doi: 10.1053/jhin.2001.1052.
32. Conen A, Raabe A, Schaller K, Fux CA, Vajkoczy P, Trampuz A. Management of neurosurgical implant-associated infections. Swiss Med Wkly. 2020 Apr 24;150:w20208. doi: 10.4414/smw.2020.20208.
33. James HE, Bradley JS. Aggressive management of shunt infection: combined intravenous and intraventricular antibiotic therapy for twelve or less days. Pediatr Neurosurg. 2008;44(2):104-11. doi: 10.1159/000113111. Epub 2008 Jan 24.
34. Edwards NC, Engelhart L, Casamento EM, McGirt MJ. Cost-consequence analysis of antibiotic-impregnated shunts and external ventricular drains in hydrocephalus. J Neurosurg. 2015 Jan;122(1):139-47. doi: 10.3171/2014.9.JNS131277.
35. Arthur AS, Whitehead WE, Kestle JR. Duration of antibiotic therapy for the treatment of shunt infection: a surgeon and patient survey. Pediatr Neurosurg. 2002 May;36(5):256-9. doi: 10.1159/000058429.
36. Pirotte BJ, Lubansu A, Bruneau M, Loqa C, Van Cutsem N, Brotchi J. Sterile surgical technique for shunt placement reduces the shunt infection rate in children: preliminary analysis of a prospective protocol in 115 consecutive procedures. Childs Nerv Syst. 2007 Nov;23(11):1251-61. doi: 10.1007/s00381-007-0415-5. Epub 2007 Aug 18.
37. Kestle JR, Riva-Cambrin J, Wellons JC 3rd, Kulkarni AV, Whitehead WE, Walker ML, Oakes WJ, Drake JM, Luerssen TG, Simon TD, Holubkov R; Hydrocephalus Clinical Research Network. A standardized protocol to reduce cerebrospinal fluid shunt infection: the Hydrocephalus Clinical Research Network Quality Improvement Initiative. J Neurosurg Pediatr. 2011 Jul;8(1):22-9. doi: 10.3171/2011.4.PEDS10551.
38. Kestle JR, Holubkov R, Douglas Cochrane D, Kulkarni AV, Limbrick DD Jr, Luerssen TG, Jerry Oakes W, Riva-Cambrin J, Rozzelle C, Simon TD, Walker ML, Wellons JC 3rd, Browd SR, Drake JM, Shannon CN, Tamber MS, Whitehead WE; Hydrocephalus Clinical Research Network. A new Hydrocephalus Clinical Research Network protocol to reduce cerebrospinal fluid shunt infection. J Neurosurg Pediatr. 2016 Apr;17(4):391-6. doi: 10.3171/2015.8.PEDS15253. Epub 2015 Dec 18.
39. Faillace WJ. A no-touch technique protocol to diminish cerebrospinal fluid shunt infection. Surg Neurol. 1995 Apr;43(4):344-50. doi: 10.1016/0090-3019(95)80060-t.
40. Rehman AU, Rehman TU, Bashir HH, Gupta V. A simple method to reduce infection of ventriculoperitoneal shunts. J Neurosurg Pediatr. 2010 Jun;5(6):569-72. doi: 10.3171/2010.2.PEDS09151.
41. Tulipan N, Cleves MA. Effect of an intraoperative double-gloving strategy on the incidence of cerebrospinal fluid shunt infection. J Neurosurg. 2006 Jan;104(1 Suppl):5-8. doi: 10.3171/ped.2006.104.1.5.
42. Rozzelle CJ, Leonardo J, Li V. Antimicrobial suture wound closure for cerebrospinal fluid shunt surgery: a prospective, double-blinded, randomized controlled trial. J Neurosurg Pediatr. 2008 Aug;2(2):111-7. doi: 10.3171/PED/2008/2/8/111.
43. Haliasos N, Bhatia R, Hartley J, Thompson D. Ioban drapes against shunt infections? Childs Nerv Syst. 2012 Apr;28(4):509-10. doi: 10.1007/s00381-012-1724-x. Epub 2012 Feb 22.
44. Klimo P Jr, Flannery AM. Pediatric hydrocephalus: systematic literature review and evidence-based guidelines. Part 6: Preoperative antibiotics for shunt surgery in children with hydrocephalus: a systematic review and meta-analysis. J Neurosurg Pediatr. 2015 Aug;16(2):237-9. doi: 10.3171/2014.7.PEDS14326a. Epub 2015 May 8. Erratum for: J Neurosurg Pediatr. 2014 Nov;14 Suppl 1:44-52.
45. Klimo P Jr, Thompson CJ, Baird LC, Flannery AM; Pediatric Hydrocephalus Systematic Review and Evidence-Based Guidelines Task Force. Pediatric hydrocephalus: systematic literature review and evidence-based guidelines. Part 7: Antibiotic-impregnated shunt systems versus conventional shunts in children: a systematic review and meta-analysis. J Neurosurg Pediatr. 2014 Nov;14 Suppl 1:53-9. doi: 10.3171/2014.7.PEDS14327.
46. Bauer DF, Baird LC, Klimo P, Mazzola CA, Nikas DC, Tamber MS, Flannery AM. Congress of Neurological Surgeons Systematic Review and Evidence-Based Guidelines on the Treatment of Pediatric Hydrocephalus: Update of the 2014 Guidelines. Neurosurgery. 2020 Nov 16;87(6):1071-1075. doi: 10.1093/neuros/nyaa434.
47. Bayston R, Grove N, Siegel J, Lawellin D, Barsham S. Prevention of hydrocephalus shunt catheter colonisation in vitro by impregnation with antimicrobials. J Neurol Neurosurg Psychiatry. 1989 May;52(5):605-9. doi: 10.1136/jnnp.52.5.605.
48. Patent: Bayston R. and Grove N. J., Antimicrobial Device and Method, No. 1987,
49. Aschoff A, Oikonomou J, Hashemi B, Schulte C, Kremer P, Wabel P, Leonhardt S, Kunze St. 482 Hydrocephalus Valves Tested in Vitro and a Review on 652 Tests Reported in Literature. Journal (Issue), 1999 Jan
50. Kockro RA, Hampl JA, Jansen B, Peters G, Scheihing M, Giacomelli R, Kunze S, Aschoff A. Use of scanning electron microscopy to investigate the prophylactic efficacy of rifampin-impregnated CSF shunt catheters. J Med Microbiol. 2000 May;49(5):441-450. doi: 10.1099/0022-1317-49-5-441.
51. Sköld O. Antibiotics and antibiotic resistance. John Wiley & Sons, Inc. 2011 Sep; doi: 10.1002/9781118075609.
52. Bayston R, Lambert E. Duration of protective activity of cerebrospinal fluid shunt catheters impregnated with antimicrobial agents to prevent bacterial catheter-related infection. J Neurosurg. 1997 Aug;87(2):247-51. doi: 10.3171/jns.1997.87.2.0247.
53. Govender ST, Nathoo N, van Dellen JR. Evaluation of an antibiotic-impregnated shunt system for the treatment of hydrocephalus. J Neurosurg. 2003 Nov;99(5):831-9. doi: 10.3171/jns.2003.99.5.0831.
54. Aryan HE, Meltzer HS, Park MS, Bennett RL, Jandial R, Levy ML. Initial experience with antibiotic-impregnated silicone catheters for shunting of cerebrospinal fluid in children. Childs Nerv Syst. 2005 Jan;21(1):56-61. doi: 10.1007/s00381-004-1052-x. Epub 2004 Oct 12.
55. Schaumann A, Bührer C, Schulz M, Thomale UW. Neuroendoscopic surgery in neonates - indication and results over a 10-year practice. Childs Nerv Syst. 2021 Nov;37(11):3541-3548. doi: 10.1007/s00381-021-05272-y. Epub 2021 Jul 3.
56. Sweid A, Weinberg JH, Abbas R, El Naamani K, Tjoumakaris S, Wamsley C, Mann EJ, Neely C, Head J, Nauheim D, Hauge J, Gooch MR, Herial N, Zarzour H, Alexander TD, Missios S, Hasan D, Chalouhi N, Harrop J, Rosenwasser RH, Jabbour P. Predictors of ventriculostomy infection in a large single-center cohort. J Neurosurg. 2020 Apr 10;134(3):1218-1225. doi: 10.3171/2020.2.JNS192051.
57. Lakomkin N, Hadjipanayis CG. The Role of Prophylactic Intraventricular Antibiotics in Reducing the Incidence of Infection and Revision Surgery in Pediatric Patients Undergoing Shunt Placement. Neurosurgery. 2021 Jan 13;88(2):301-305. doi: 10.1093/neuros/nyaa413. Erratum in: Neurosurgery. 2021 Apr 15;88(5):1042.
58. Mbabazi-Kabachelor E, Shah M, Vaughan KA, Mugamba J, Ssenyonga P, Onen J, Nalule E, Kapur K, Warf BC. Infection risk for Bactiseal Universal Shunts versus Chhabra shunts in Ugandan infants: a randomized controlled trial. J Neurosurg Pediatr. 2019 Jan 4;23(3):397-406. doi: 10.3171/2018.10.PEDS18354.
59. Parker SL, McGirt MJ, Murphy JA, Megerian JT, Stout M, Engelhart L. Cost savings associated with antibiotic-impregnated shunt catheters in the treatment of adult and pediatric hydrocephalus. World Neurosurg. 2015 Mar;83(3):382-6. doi: 10.1016/j.wneu.2014.06.010. Epub 2014 Jun 13.
60. Goda R, Ganeshkumar A, Katiyar V, Sharma R, Gurjar HK, Chaturvedi A, Sahu R, Rai HIS, Vora Z. Efficacy of antimicrobial medicated ventricular catheters: a network meta-analysis with trial sequential analysis. Neurosurg Rev. 2022 Feb;45(1):91-102. doi: 10.1007/s10143-021-01532-2. Epub 2021 May 19.
